Perbezaan antara undang -undang gas gabungan dan undang -undang gas ideal
Perbezaan utama - Undang -undang Gas Gabungan vs Sesuai Undang -undang Gas
Semasa mengkaji tentang gas yang berbeza, hubungan antara kelantangan, tekanan, suhu gas dan jumlah gas yang ada sangat penting. Hubungan ini diberikan oleh undang -undang gas yang ideal dan undang -undang gas gabungan. Apabila menerangkan undang -undang ini, istilah "gas ideal" sering digunakan. Gas yang ideal tidak wujud dalam realiti tetapi adalah sebatian gas hipotesis. Ia tidak mempunyai daya intermolecular antara molekul gas. Walau bagaimanapun, sesetengah gas boleh berkelakuan sebagai gas yang ideal apabila keadaan yang betul (suhu dan tekanan) disediakan. Undang -undang gas dibuat untuk gas ideal. Apabila menggunakan undang -undang gas ini untuk gas sebenar, beberapa pembetulan dipertimbangkan. Undang -undang gas gabungan adalah gabungan tiga undang -undang gas; Undang-undang Boyle, Undang-undang Charles, dan Undang-undang Gay-Lussac. The Perbezaan utama antara undang -undang gas gabungan dan undang -undang gas ideal adalah, Undang -undang Gas Gabungan adalah koleksi tiga undang -undang gas manakala undang -undang gas ideal adalah undang -undang gas individu.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Gabungan Undang -undang Gas
3. Apa itu Undang -undang Gas Ideal
4. Hubungan antara undang -undang gas gabungan dan undang -undang gas ideal
5. Perbandingan sampingan - Undang -undang Gas Gabungan vs Undang -undang Gas Ideal dalam Bentuk Tabular
6. Ringkasan
Apa itu Gabungan Undang -undang Gas?
Undang -undang gas gabungan terbentuk daripada gabungan tiga undang -undang gas; Undang-undang Boyle, Undang-undang Charles, dan Undang-undang Gay-Lussac. Undang -undang gas gabungan menunjukkan bahawa nisbah produk tekanan dan kelantangan dan suhu mutlak gas adalah sama dengan pemalar.
Pv/t = k
Di mana p adalah tekanan, v adalah isipadu, t adalah suhu dan k adalah malar. Apabila undang -undang gas gabungan digunakan bersama dengan undang -undang Avogadro, ia mengakibatkan undang -undang gas yang ideal. Undang -undang gas gabungan tidak mempunyai pemilik atau penemuan. Hubungan di atas dapat diberikan seperti di bawah juga.
P1v1/t1 = p2v2/t2
Ini memberikan hubungan antara kelantangan, suhu dan tekanan gas ideal di dua negeri. Oleh itu, persamaan ini boleh digunakan untuk menjelaskan dan meramalkan parameter ini pada keadaan awal atau keadaan akhir.
Undang -undang Boyle
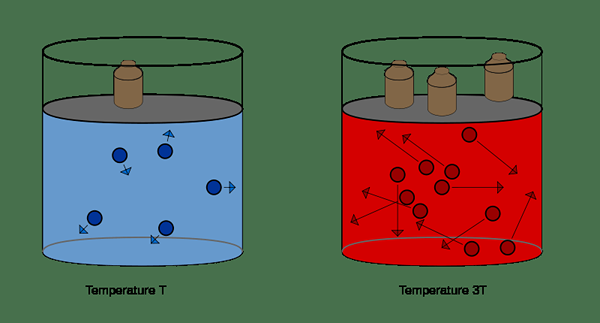
Pada suhu malar, jumlah gas ideal berkadar songsang dengan tekanan gas itu. Ini bermakna produk tekanan awal (p1) dan isipadu awal (v1) adalah sama dengan produk tekanan akhir (p2) dan isipadu akhir (v2) gas yang sama.
P1v1 = p2v2
Undang -undang Charles
Pada tekanan yang berterusan, jumlah gas ideal berkadar terus dengan suhu gas tersebut. Undang -undang ini boleh diberikan seperti di bawah.
V1/T1 = V2/T2
Rajah 01: Ilustrasi Undang-undang Tekanan Tekanan
Undang-undang Gay-Lussac
Pada jumlah yang berterusan, tekanan gas ideal berkadar terus dengan suhu gas yang sama. Ini boleh diberikan seperti di bawah,
P1/T1 = P2/T2
Apa itu Undang -undang Gas Ideal?
Undang -undang gas yang ideal adalah undang -undang asas dalam kimia, dan ia menunjukkan bahawa produk tekanan (p) dan isipadu (v) gas ideal adalah berkadar terus dengan produk suhu (t) dan beberapa zarah gas ( n).
Pv = knt
Di sini, k adalah pemalar perkadaran. Ia dikenali sebagai pemalar Boltzmann. Nilai pemalar ini didapati 1.38 x 10-23 J/k. Walau bagaimanapun, gas ideal hanya dinyatakan seperti berikut.
Pv = nrt
Di mana n adalah bilangan tahi lalat gas hadir, dan r adalah pemalar gas sejagat yang diberikan oleh 8.314 jmol-1K-1. Persamaan ini hanya boleh digunakan untuk gas ideal. Sekiranya perlu digunakan untuk gas sebenar, beberapa pembetulan dibuat kerana gas sebenar mempunyai banyak pengecualian dari gas ideal.
Persamaan baru ini dikenali sebagai Persamaan Van der Waals. Ia diberikan seperti di bawah.
(P + a n/v2) (V/n - b) = rt
Dalam persamaan ini, "A" adalah malar yang bergantung kepada jenis gas dan B juga adalah malar yang memberikan isipadu setiap tahi lalat gas (diduduki oleh molekul gas).
Apakah hubungan antara undang -undang gas gabungan dan undang -undang gas ideal?
- Apabila undang -undang gas gabungan digunakan bersama dengan undang -undang Avogadro, ia mengakibatkan undang -undang gas yang ideal.
Apakah perbezaan antara undang -undang gas gabungan dan undang -undang gas yang ideal?
Undang -undang Gas Gabungan vs Undang -undang Gas Ideal | |
| Undang -undang gas gabungan terbentuk daripada gabungan tiga undang -undang gas; Undang-undang Boyle, Undang-undang Charles, dan Undang-undang Gay-Lussac. | Undang -undang gas yang ideal adalah undang -undang asas dalam kimia; Ia menunjukkan bahawa produk tekanan (p) dan isipadu (v) gas ideal adalah berkadar terus dengan produk suhu (t) dan beberapa zarah gas (n). |
| Pembentukan | |
| Undang-undang Gas Gabungan Dibentuk oleh Gabungan Undang-undang Boyle, Undang-undang Charles, dan Undang-undang Gay-Lussac. | Undang -undang Gas Ideal adalah undang -undang individu. |
| Persamaan | |
| Undang -undang gas gabungan diberikan oleh pv/t = k | Undang -undang Gas Ideal diberikan oleh PV = NRT |
Ringkasan - Undang -undang gas gabungan vs Sesuai Undang -undang Gas
Undang -undang gas digunakan untuk memahami dan meramalkan tingkah laku dan sifat gas. Perbezaan antara undang -undang gas gabungan dan undang -undang gas yang ideal adalah, undang -undang gas gabungan adalah koleksi tiga undang -undang gas manakala undang -undang gas ideal adalah undang -undang gas individu. Undang-undang Gas Gabungan Dibentuk dari Undang-undang Boyle, Undang-undang Charles, dan Undang-undang Gay-Lussac.
Rujukan:
1.Helmenstine, Anne Marie. "Memahami undang -undang gas gabungan dalam kimia."Pemikiran. Terdapat di sini
2.Helmenstine, Anne Marie. "Apakah undang -undang gas yang ideal? Kaji konsep kimia anda."Pemikiran. Terdapat di sini
3."Bagaimana undang -undang gas ideal berbeza dari undang -undang gas gabungan? | Socratic."Org. Terdapat di sini
Ihsan gambar:
1.'Tekanan suhu Law'y Egmason - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
2.'37147128632'by Travis Wise (CC oleh 2.0) melalui Flickr


