Perbezaan antara reaksi gabungan dan penguraian

Perbezaan utama - Gabungan vs reaksi penguraian
Reaksi kimia adalah penukaran satu atau lebih sebatian kimia menjadi satu atau lebih produk yang berbeza, mengubah identiti sebatian kimia. Bahan permulaan tindak balas kimia dipanggil reaktan dan sebatian yang dihasilkan dipanggil produk. Pecahan sebatian atau gabungan sebatian dan pembentukan sebatian baru akan berlaku semasa proses tindak balas kimia kerana ikatan antara atom sebatian dipecahkan dan dibuat dengan cara yang berbeza. Reaksi kimia boleh dibahagikan kepada beberapa kategori yang luas. Tindak balas redoks atau tindak balas pengurangan pengoksidaan sangat penting di kalangan mereka. Reaksi pengoksidaan dan pengurangan dipanggil tindak balas pemindahan elektron kerana elektron reaktan dipindahkan dari satu sebatian ke yang lain untuk menyebabkan reaksi. Dalam tindak balas redoks, dua reaksi selari, yang dipanggil separuh tindak balas, berlaku pada masa yang sama. Reaksi separuh ini menunjukkan pemindahan elektron. Dengan mengimbangi separuh reaksi ini, seseorang dapat meneka reaksi keseluruhan yang telah berlaku pada akhirnya. Reaksi gabungan dan tindak balas penguraian adalah dua jenis utama reaksi redoks. Perbezaan utama antara gabungan dan tindak balas penguraian ialah Reaksi gabungan melibatkan gabungan reaktan untuk memberikan produk tunggal sedangkan Reaksi penguraian melibatkan pecahan sebatian tunggal menjadi dua atau lebih produk.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah reaksi gabungan
3. Apakah reaksi penguraian
4. Perbandingan sampingan - gabungan vs reaksi penguraian
5. Ringkasan
Apakah reaksi gabungan?
Tindak balas gabungan, juga dipanggil sebagai tindak balas sintesis, adalah tindak balas di mana sebatian reaktan digabungkan untuk membentuk sebatian yang berbeza seperti produk. Dengan kata lain, tindak balas molekul mudah menghasilkan molekul kompleks. Sesetengah atau semua ikatan antara atom sebatian tertentu dipecahkan; Pada masa yang sama, atom akan bergabung untuk membentuk sebatian baru, yang merupakan produk. Dalam tindak balas penguraian, reaktan yang sama bertindak sebagai bahan permulaan untuk kedua -dua reaksi separuh. Tidak seperti dalam tindak balas penguraian, separuh tindak balas dalam reaksi gabungan mempunyai reaktan yang berbeza untuk bermula dengan. Tindak balas gabungan menghasilkan satu produk. Berikut adalah contoh biasa yang boleh diberikan sebagai tindak balas pembakaran.
Contohnya, apabila aluminium (AL) diletakkan dalam bromida cecair (BR2) tindak balas gabungan berlaku dan menghasilkan bromida aluminium (ALBR3). Di sini, bilangan pengoksidaan meningkat di Al dan menurun dalam BR. Oleh itu, ia adalah tindak balas redoks dan merupakan tindak balas gabungan kerana dua reaktan telah bertindak balas untuk memberikan satu produk tertentu.
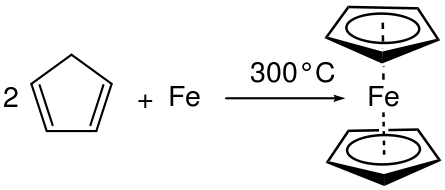
Rajah 01: Reaksi gabungan
Apakah reaksi penguraian?
Reaksi penguraian adalah tindak balas penting dalam kategori reaksi redoks. Pada dasarnya adalah bertentangan dengan reaksi gabungan. Reaksi penguraian adalah tindak balas di mana sebatian reaktan dipecah menjadi produk. Di sini, separuh reaksi berlaku pada masa yang sama dengan tindak balas pengoksidaan dan tindak balas pengurangan. Tetapi tidak seperti dalam reaksi gabungan, reaktan untuk kedua -dua reaksi separuh adalah sama dalam reaksi penguraian. Tindak balas penguraian menghasilkan beberapa produk.
Dalam elektrolisis air, apabila arus langsung dilalui melalui air, molekul air diuraikan untuk memberikan gas oksigen dan hidrogen. Di sini, bilangan pengoksidaan meningkat dalam atom oksigen dan menurun dalam atom hidrogen. Oleh itu, ia adalah tindak balas redoks dan tindak balas penguraian kerana pecahan molekul air ke dalam gas oksigen dan hidrogen.

Rajah 02: Gabungan vs penguraian
Apakah perbezaan antara gabungan dan reaksi penguraian?
Gabungan vs reaksi penguraian | |
| Dua atau lebih sebatian reaktan terlibat dalam reaksi gabungan. | Sebatian tunggal terlibat dalam tindak balas penguraian. |
| Produk | |
| Tindak balas gabungan menghasilkan satu produk. | Reaksi penguraian menghasilkan beberapa produk. |
| Separuh reaksi | |
| Dalam reaksi gabungan, dua reaksi separuh mempunyai dua molekul permulaan yang berbeza. | Dalam tindak balas penguraian, satu molekul bertindak sebagai bahan permulaan untuk kedua -dua reaksi separuh. |
| Ikatan kimia | |
| Reaksi gabungan menghasilkan ikatan atom untuk menghasilkan produk akhir tunggal. | Dalam tindak balas penguraian, ikatan kimia dipecahkan untuk membentuk dua atau lebih produk akhir. |
| Molekul | |
| Reaksi gabungan menyebabkan molekul mudah bertindak balas dan menghasilkan molekul kompleks. | Reaksi penguraian menyebabkan molekul kompleks untuk memecah menjadi molekul mudah. |
Ringkasan -Gabungan vs Reaksi Penguraian
Reaksi redoks adalah sebahagian daripada dunia di sekeliling kita kerana majoriti tindak balas kimia penting adalah reaksi redoks. Reaksi gabungan dan tindak balas penguraian adalah tindak balas mudah yang bertentangan antara satu sama lain. Perbezaan utama antara gabungan dan tindak balas penguraian ialah tindak balas gabungan melibatkan gabungan dua atau lebih molekul reaktan untuk menghasilkan satu produk akhir manakala tindak balas penguraian melibatkan pecahan molekul tunggal ke dalam dua atau lebih produk.
Rujukan:
1.Chang, r., 2010. Kimia. Edisi ke -10. NewYork: McGraw-Hill.
2.Redoks. (2009, 30 Julai). Diperoleh pada 29 Mei 2017, dari https: // lemah.WordPress.com/primer/redoks/
3.Reaksi. (n.d.). Diperoleh pada 29 Mei 2017, dari http: // www.Ric.edu/fakulti/ptiskus/reaksi/
Ihsan gambar:
1. "Miller Ferrocen Synthese" oleh Bert.Kilanowski - Kerja Sendiri (CC0) melalui Commons Wikimedia
2. "Reaksi Kimia" oleh Daniele Pugliesi - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia [dipotong]


