Perbezaan antara klorit dan klorida
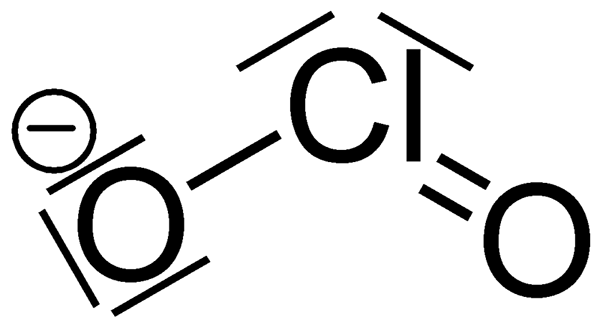
The Perbezaan utama antara klorit dan klorida Adakah ion klorit adalah ejen pengoksidaan yang kuat, sedangkan klorida bukan ejen pengoksidaan.
Klorit dan klorida adalah anion yang berasal dari atom klorin. Anion ini dapat meningkatkan keadaan pengoksidaan mereka semasa tindak balas kimia, tetapi hanya ion klorit yang dapat mengurangkan keadaan pengoksidaannya juga, sementara ion klorida tidak dapat. Oleh itu, klorit adalah ejen pengoksidaan, tetapi ion klorida tidak.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu klorit
3. Apa itu klorida
4. Perbandingan sampingan -klorit vs klorida dalam bentuk jadual
5. Ringkasan
Apa itu klorit?
Chlorite adalah anion yang mempunyai formula kimia CLO2-. Jisim molar anion ini ialah 67.45 g/mol. Ia juga dikenali sebagai anion klorin dioksida, dan ia adalah contoh halite. Sebatian klorit adalah sebatian kimia yang mengandungi anion ini; Klorin berada dalam keadaan pengoksidaan +3. Klorit adalah garam asid keratan.
Apabila mempertimbangkan kimia ion klorit, ia mempunyai geometri molekul bengkok kerana kesan pasangan elektron tunggal pada atom klorin. Sudut ikatan ikatan O-CL-O adalah kira-kira 111 darjah. Selain itu, klorit adalah ejen pengoksidaan terkuat di kalangan pengoksidaan klorin lain, bergantung kepada potensi sel separuh.
Aplikasi klorit yang paling biasa adalah garam natriumnya (natrium klorit) yang berguna dalam pemutihan tekstil, pulpa, dan kertas kerana sifat pengoksidaan yang kuat. Walau bagaimanapun, ia tidak digunakan secara langsung, dan sebaliknya, kita perlu menjana spesies klorin dioksida neutral melalui tindak balas dengan HCL.
Apa itu klorida?
Klorida adalah anion yang mempunyai formula kimia cl-. Anion ini berasal dari atom klorin. Biasanya, atom klorin terdiri daripada 17 elektron, dan ia mempunyai konfigurasi elektron yang tidak stabil kerana pengisian orbital yang tidak lengkap. Oleh itu, atom klorin sangat reaktif dan membentuk ion klorida dengan mendapatkan elektron dari luar. Elektron yang masuk ini menduduki orbital paling luar atom klorin. Tetapi tidak cukup caj positif dalam nukleus klorin untuk meneutralkan caj negatif elektron itu. Oleh itu, ia membentuk anion yang dipanggil ion klorida. Contoh umum sebatian yang mengandungi ion klorida ialah garam meja atau natrium klorida.
Ion klorida mempunyai 18 elektron. Konfigurasi elektron serupa dengan atom argon. Ia kurang reaktif, dan elektronegativiti juga sangat kurang. Ia cenderung untuk menangkis mana -mana elektron masuk lain kerana caj negatifnya.
Sebatian yang mengandungi ion klorida biasanya dipanggil klorida. Sebilangan besar klorida ini larut dalam air. Apabila sebatian ini dibubarkan di dalam air, anion dan kation dipisahkan antara satu sama lain. Oleh kerana ion -ion ini dikenakan ion elektrik, penyelesaian yang terdiri daripada ion klorida dan mana -mana kation lain boleh menjalankan arus elektrik melalui penyelesaian.
Perbezaan antara klorit dan klorida
Klorit dan klorida adalah anion yang berasal dari atom klorin. Chlorite adalah anion yang mempunyai formula kimia CLO2- Walaupun klorida adalah anion yang mempunyai formula kimia cl-. Klorit adalah oksion dan mengandungi atom oksigen selain klorin. Perbezaan utama antara klorit dan klorida ialah ion klorit adalah ejen pengoksidaan yang kuat, sedangkan klorida bukan ejen pengoksidaan tetapi ia boleh bertindak sebagai ejen pengurangan.
Berikut adalah ringkasan perbezaan antara klorit dan klorida dalam bentuk jadual.
Ringkasan -klorit vs klorida
Klorit dan klorida adalah anion yang berasal dari atom klorin. Perbezaan utama antara klorit dan klorida ialah ion klorit adalah ejen pengoksidaan yang kuat, sedangkan klorida bukan ejen pengoksidaan.
Rujukan:
1. "Halogen sebagai ejen pengoksidaan." Kimia Libreetexts, Libretexts.
Ihsan gambar:
1. "Klorisi" oleh Eschenmoser - Kerja Sendiri Menggunakan: ChemDraw 8.0 (Domain Awam) melalui Commons Wikimedia


