Perbezaan antara klorat dan perchlorate
The Perbezaan utama antara klorat dan perchlorate adalah Klorat adalah anion yang diperolehi daripada pemisahan asid klorik manakala perchlorate adalah anion yang diperoleh daripada pemisahan asid perchloric.
Klorat dan perchlorate adalah oksion yang mengandungi atom klorin dan oksigen. Secara umum, istilah ini juga digunakan untuk menamakan garam asid klorik dan perchloric masing -masing. Dalam erti kata lain, istilah klorat boleh merujuk kepada mana -mana sebatian yang mengandungi anion klorat dengan kation lain.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu klorat
3. Apa itu perchlorate
4. Perbandingan sampingan - klorat vs perchlorate dalam bentuk jadual
5. Ringkasan
Apa itu klorat?
Chlorate adalah anion yang mempunyai formula kimia CLO3-. Keadaan pengoksidaan atom chorine adalah +5. Walau bagaimanapun, sebatian kimia yang mengandungi anion ini juga dinamakan sebagai klorat sebagai istilah umum. Anion ini adalah garam asid choric. Struktur anion ini adalah seperti berikut:
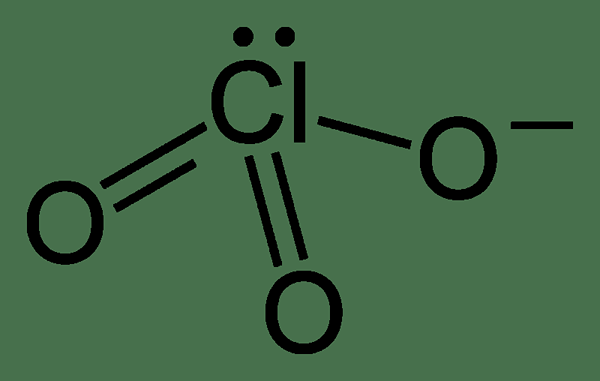
Geometri anion ini adalah piramid trigonal. Selain itu, sebatian yang mengandungi anion ini adalah pengoksidaan yang kuat. Oleh itu, kita harus menjauhkannya dari bahan yang mudah dioksidakan. Anion ini boleh menunjukkan resonans; oleh itu struktur sebenar klorat adalah struktur hibrid, yang mempunyai semua ikatan cl-o dengan panjang yang sama. Selain itu, atom klorin di sini adalah hipervalen. Ini bermakna atom klorin mempunyai lebih daripada lapan elektron di sekelilingnya.
Apabila mempertimbangkan penyediaan, di makmal, kita boleh menghasilkan klorat dengan menambahkan klorin ke hidroksida panas, i.e. Koh. Dalam skala perindustrian, kita dapat menghasilkannya dari elektrolisis natrium klorida berair.
Apa itu perchlorate?
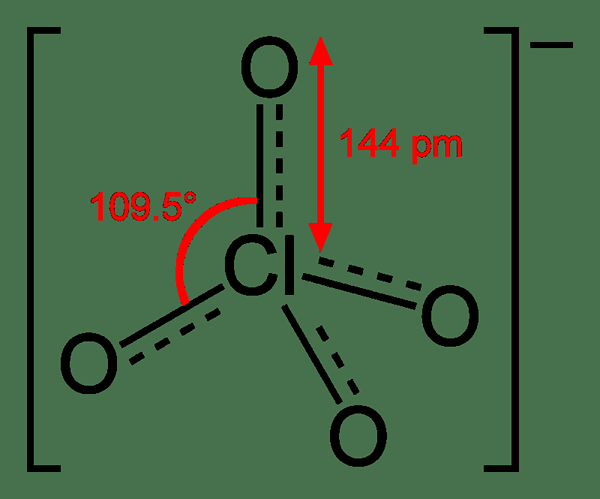
Perchlorate adalah anion yang mempunyai formula kimia clo4-. Ia berasal dari asid perchloric. Secara umum, istilah ini boleh merujuk kepada mana -mana sebatian yang mengandungi anion perchlorate. Keadaan pengoksidaan atom chorine dalam sebatian ini adalah +7. Ia adalah bentuk reaktif yang paling sedikit di kalangan klorat lain. Geometri ion ini adalah tetrahedral.

Kebanyakannya, sebatian yang mengandungi anion ini wujud sebagai pepejal tidak berwarna yang larut dalam air. Anion ini membentuk apabila sebatian perchlorate memisahkan air. Dalam skala perindustrian, kita boleh menghasilkan ion ini melalui kaedah elektrolisis; Di sini, pengoksidaan natrium klorat berair berlaku.
Apakah perbezaan antara klorat dan perchlorate?
Perbezaan utama antara klorat dan perchlorate adalah bahawa klorat adalah anion yang diperolehi daripada pemisahan asid klorik manakala perchlorate adalah anion yang diperolehi daripada pemisahan asid perchloric. Tambahan pula, keadaan pengoksidaan atom klorin dalam klorat adalah +5 dan keadaan pengoksidaan perchlorate adalah +7. Apabila mempertimbangkan geometri anion ini, anion klorat mempunyai geometri piramidal trigonal dan anion perchlorate mempunyai geometri tetrahedral.
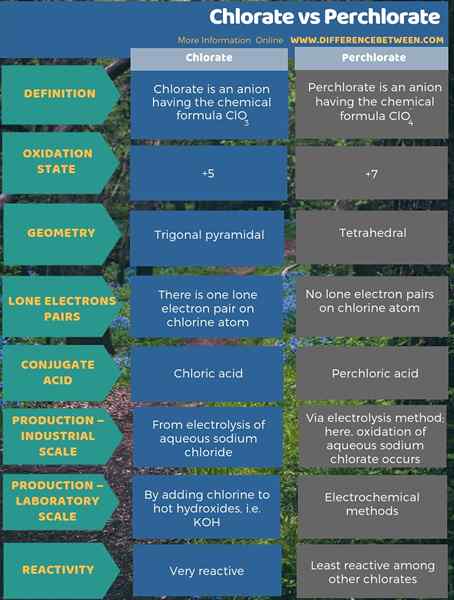
Ringkasan -klorat vs perchlorate
Klorat dan perchlorate pada dasarnya adalah pengoksidaan chorine. Perbezaan utama antara klorat dan perchlorate adalah bahawa klorat adalah anion yang diperolehi daripada pemisahan asid klorik manakala perchlorate adalah anion yang diperolehi daripada pemisahan asid perchloric.
Rujukan:
1. "Klorat."Wikipedia, Yayasan Wikimedia, 27 Ogos. 2019, boleh didapati di sini.
Ihsan gambar:
1. "Chlorate-2d" oleh Benjah-Bmm27-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Perchlorate-2d-dimensi" oleh Benjah-Bmm27-Kerja sendiri (Domain Awam) melalui Commons Wikimedia


