Perbezaan antara keseimbangan kimia dan keseimbangan dinamik
The Perbezaan utama antara keseimbangan kimia dan keseimbangan dinamik ialah Keseimbangan kimia menerangkan keadaan di mana kepekatan reaktan dan produk tidak mengalami sebarang perubahan sedangkan keseimbangan dinamik menerangkan keadaan di mana nisbah reaktan dan produk tidak berubah, tetapi bahan bergerak antara bahan kimia pada kadar yang sama.
Apabila satu atau lebih reaktan dapat ditukar kepada produk, mereka mungkin melalui perubahan pengubahsuaian dan tenaga yang berbeza. Bon kimia dalam reaktan pecah, dan ikatan baru terbentuk untuk menghasilkan produk, yang sama sekali berbeza dengan reaktan. Kami namakan pengubahsuaian kimia seperti ini sebagai tindak balas kimia. Thermodynamics adalah kajian transformasi tenaga yang berkenaan dengan energik dan kedudukan keseimbangan dalam reaksi.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah keseimbangan kimia
3. Apakah keseimbangan dinamik
4. Perbandingan sampingan - keseimbangan kimia vs keseimbangan dinamik dalam bentuk jadual
6. Ringkasan
Apakah keseimbangan kimia?
Keseimbangan kimia adalah keadaan di mana kedua -dua reaktan dan produk hadir dalam kepekatan yang tidak mempunyai kecenderungan selanjutnya untuk berubah dengan masa. Beberapa tindak balas boleh diterbalikkan, dan beberapa tindak balas tidak dapat dipulihkan. Dalam tindak balas, reaktan menukarkan produk. Dan dalam beberapa tindak balas, reaktan menghasilkan lagi dari produk. Oleh itu, tindak balas jenis ini boleh diterbalikkan.
Dalam tindak balas yang tidak dapat dipulihkan, apabila reaktan ditukar kepada produk, mereka tidak akan menjana semula dari produk. Dalam tindak balas yang boleh diterbalik.

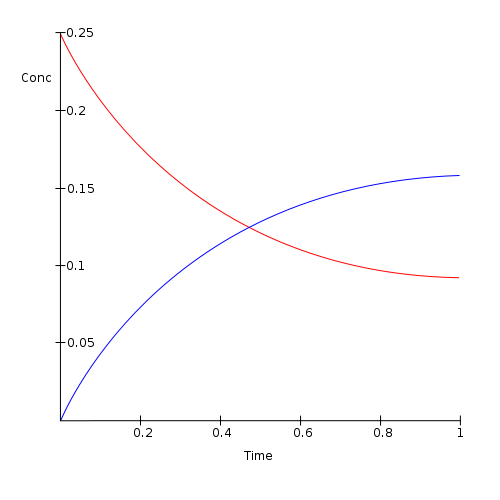
Rajah 01: Jumlah reaktan (merah) penurunan dan jumlah produk (dalam warna biru) selepas keseimbangan kimia
Sifat reaksi
Apabila kadar tindak balas ke hadapan dan mundur adalah sama, maka tindak balas adalah pada keseimbangan. Oleh itu, sejak beberapa waktu jumlah reaktan dan produk tidak berubah. Reaksi yang boleh diterbalikkan selalu cenderung untuk datang ke keseimbangan dan mengekalkan keseimbangan itu. Apabila sistem berada dalam keseimbangan, jumlah produk dan reaktan tidak semestinya sama. Terdapat jumlah reaktan yang lebih tinggi daripada produk atau sebaliknya. Satu -satunya keperluan dalam persamaan keseimbangan adalah untuk mengekalkan jumlah yang berterusan dari kedua -dua masa. Untuk tindak balas dalam keseimbangan, kita boleh menentukan pemalar keseimbangan; di mana ia sama dengan nisbah antara kepekatan produk dan kepekatan reaksi.
K = [produk]n/[reaktan]m
Di mana, n dan m adalah pekali stoikiometrik produk dan reaktan. Untuk tindak balas keseimbangan, jika tindak balas ke hadapan adalah eksotermik, maka tindak balas mundur adalah endotermik dan sebaliknya. Biasanya, semua parameter lain untuk reaksi ke hadapan dan mundur bertentangan antara satu sama lain seperti ini. Oleh itu, jika kita mahu memudahkan salah satu tindak balas, kita hanya perlu menyesuaikan parameter untuk memudahkan reaksi itu.
Apakah keseimbangan dinamik?
Keseimbangan dinamik juga merupakan jenis keseimbangan di mana jumlah produk dan reaktan tidak berubah dari masa ke masa. Walau bagaimanapun, dalam keseimbangan dinamik, dengan mengatakan bahawa jumlah tidak berubah tidak bermakna bahawa reaksi telah berhenti. Sebaliknya, tindak balas itu diteruskan dengan cara yang menyimpan jumlahnya tidak berubah (perubahan bersih adalah sifar).
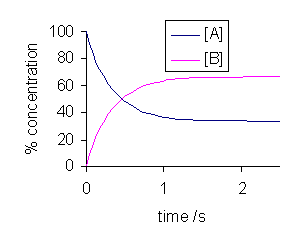
Rajah 02: Perubahan tindak balas ke hadapan dan ke belakang dalam keseimbangan dinamik
Cukup perkataan "keseimbangan dinamik" bermaksud reaksi itu boleh diterbalikkan dan berterusan. Untuk keseimbangan dinamik berlaku, sistem harus ditutup, sehingga tidak ada tenaga atau bahan yang melarikan diri dari sistem.
Apakah perbezaan antara keseimbangan kimia dan keseimbangan dinamik?
Keseimbangan dinamik adalah jenis keseimbangan kimia. Perbezaan utama antara keseimbangan kimia dan keseimbangan dinamik ialah keseimbangan kimia menerangkan keadaan di mana kepekatan reaktan dan produk tidak mengalami sebarang perubahan, sedangkan keseimbangan dinamik menggambarkan keadaan di mana nisbah reaktan dan produk tidak berubah, tetapi bahan bergerak antara bahan kimia pada kadar yang sama.
Selain itu, dalam keseimbangan dinamik, tindak balas berterusan, tetapi jumlah reaktan dan produk tetap tidak berubah kerana kadar tindak balas ke hadapan dan ke belakang adalah sama. Terdapat beberapa contoh dalam keseimbangan kimia di mana jumlah produk dan reaktan tetap tidak berubah kerana reaksi telah berhenti. Jadi, ini juga perbezaan antara keseimbangan kimia dan keseimbangan dinamik.
Di bawah infographic mengenai perbezaan antara keseimbangan kimia dan keseimbangan dinamik memberikan lebih banyak maklumat mengenai perbezaan ini.

Ringkasan -Keseimbangan Kimia Vs Keseimbangan Dinamik
Keseimbangan adalah keadaan sistem yang tidak menunjukkan perubahan bersih. Keseimbangan kimia memperoleh keadaan ini apabila tindak balas berhenti sementara keseimbangan dinamik memperoleh keadaan ini apabila kadar tindak balas ke hadapan dan mundur adalah sama. Perbezaan utama antara keseimbangan kimia dan keseimbangan dinamik ialah keseimbangan kimia menerangkan keadaan di mana kepekatan reaktan dan produk tidak mengalami sebarang perubahan, sedangkan keseimbangan dinamik menggambarkan keadaan di mana nisbah reaktan dan produk tidak berubah, tetapi bahan -bahan bergerak antara bahan kimia pada kadar yang sama.
Rujukan:
1. "Keseimbangan Kimia - Jenis, Prinsip dan Undang -Undang Keseimbangan."Toppr bytes, toppr.com, 16 mar. 2018. Terdapat di sini
"Keseimbangan Dinamik."Wikipedia, Yayasan Wikimedia, 17 Dis. 2018. Terdapat di sini
Ihsan gambar:
1."ChemicalEquilibrium" oleh Fintelia - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
2."Keseimbangan Dinamik" oleh Petergans di Bahasa Inggeris Wikipedia - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


