Perbezaan antara ejen chelating dan ejen penyerapan
Perbezaan Utama - Ejen Chelating vs Ejen Pengasingan
Ejen chelating dan ejen penyerapan mengeluarkan ion logam dari penyelesaian dengan membentuk kompleks dengan ion logam tertentu. Proses ini dipanggil chelation. Ia boleh digunakan untuk menghilangkan kekerasan air atau logam berat dari air. Ramai chelators dan sequestrants mempunyai keutamaan ion logam, yang bermaksud, chelator atau sequestrant akan mengikat dengan ion logam tertentu sebelum mengikat dengan ion logam lain dalam sistem itu. Perbezaan utama antara ejen chelating dan ejen penyerapan ialah Ejen chelating boleh mengikat dengan ion logam tunggal sedangkan Ejen penyerap boleh mengikat dengan beberapa ion logam pada satu masa.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu ejen chelating
3. Apa itu ejen penyerapan
4. Persamaan antara ejen chelating dan ejen penyerapan
5. Perbandingan sampingan - Ejen Chelating Vs Ejen Penggabungan dalam Bentuk Tabular
6. Ringkasan
Apa itu ejen chelating?
Ejen chelating adalah bahan yang mempunyai keupayaan untuk membuat beberapa ikatan dengan ion logam tunggal dan membentuk kompleks. Ion logam tidak dapat mengambil bahagian dalam sebarang tindak balas lain yang berlaku dalam sistem kerana pembentukan kompleks. Ini dipanggil chelation. Jika ejen chelating membuat dua bon dengan ion logam, ejen chelating dipanggil Bidentate; Sekiranya ia membentuk lebih banyak bon, ia dipanggil multidentate.
Ejen chelating membentuk kompleks logam larut air yang stabil. Ini menghalang logam daripada mengambil bahagian dalam reaksi biasa. Ejen chelating membentuk ikatan koordinasi dengan ion logam, mengubah struktur kimia ion logam. Ejen chelating sangat penting dalam tindak balas kimia. Jika penyelesaian mempunyai campuran dua ion logam, kita boleh menambah ejen chelating untuk mengelakkan ion logam lain daripada mengganggu reaksi untuk mencari jumlah satu ion logam yang ada dalam penyelesaian. Ejen chelating sama ada sebatian organik semula jadi atau sintetik yang digunakan dalam aplikasi perindustrian atau biologi.
Contoh ejen chelating yang baik adalah Ethylenediamine. Ia boleh membentuk dua ikatan dengan ion logam peralihan seperti nikel (II). Ion nikel mempunyai enam elektron kovalen; Dengan kata lain, ia mempunyai tiga pasang elektron. Oleh itu, tiga molekul etilenediamin akan mengikat dengan satu ion logam.
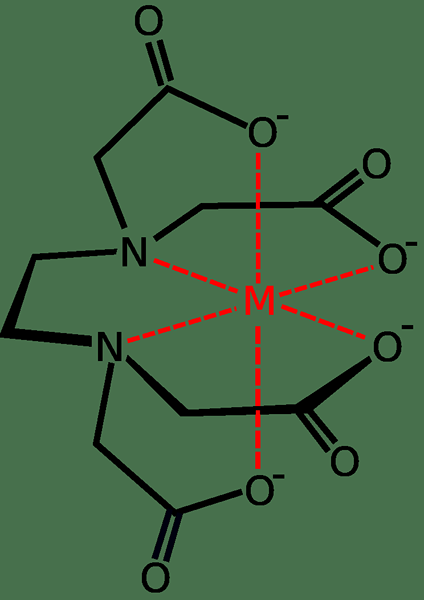
Contoh biasa ialah EDTA. Ia kebanyakannya digunakan dalam sabun dan detergen kerana molekul EDTA dapat mengikat dengan ion kalsium dan magnesium dalam air keras, mencegah gangguan dalam proses pembersihan sabun dan detergen.

Rajah 01: EDTA mengikat dengan ion logam tunggal
Apa itu ejen penyerapan?
Ejen penyerapan adalah bahan kimia yang boleh mengikat dengan ion logam dalam penyelesaian. Gabungan ejen penyerapan dan ion logam membentuk kompleks larut air yang stabil. Maka ion logam tertentu tidak dapat menjalani tindak balas lain (reaksi yang dimiliki oleh ion logam ketika tidak ada ejen penyerapan). Walaupun ia menunjukkan tindakan yang sama sebagai ejen chelating, ia berbeza dari ejen chelating dengan cara "salutan" ion logam; Ejen penyerapan terdiri daripada beberapa tapak aktif yang boleh mengikat dengan ion logam. Ini menyebabkan ejen penyerapan menjadi lebih kuat daripada ejen chelating kerana ejen chelating hanya dapat mengikat dengan ion logam tunggal.
Kebanyakan masa, ion logam menyerupai susunan rantai. Kemudian pengikatan ejen penyerapan ke hujung rantai membentuk struktur seperti cincin yang mudah dikeluarkan.
Apakah persamaan antara ejen chelating dan ejen pengambilan?
- Ejen penyerapan juga merupakan jenis ejen chelating.
- Kedua -dua agen chelating dan sequestering dapat mengikat dengan ion logam dalam larutan dan dapat menghalang ion logam daripada menjalani reaksi normalnya.
- Ejen chelating dan ejen penyerapan adalah sebatian organik yang boleh menjadi semula jadi atau sintetik.
- Kedua -duanya boleh membentuk kompleks larut air yang stabil dengan ion logam.
Apakah perbezaan antara ejen chelating dan ejen penyerapan?
Agen Chelating vs Ejen Penggabungan | |
| Ejen chelating adalah sebatian kimia yang boleh mengikat dengan ion logam dalam larutan dan menghalangnya dari reaksi normalnya. | Ejen penyerapan adalah sebatian kimia yang dapat mengikat dengan beberapa ion logam dalam larutan dan menghalangnya dari reaksi normalnya. |
| Bilangan ion logam | |
| Ejen chelating mengikat dengan ion logam tunggal pada satu masa. | Ejen penyerapan boleh mengikat dengan beberapa ion logam pada satu masa. |
| Tapak aktif | |
| Ejen chelating mempunyai satu tapak aktif setiap molekul. | Ejen penyerapan mempunyai beberapa tapak aktif setiap molekul. |
| Potensi | |
| Ejen chelating kurang berkuasa kerana kehadiran satu tapak aktif. | Ejen penyerapan lebih kuat kerana kehadiran beberapa laman web aktif. |
| Pembentukan kompleks | |
| Ejen chelating membentuk molekul kompleks yang larut air. | Ejen penyerapan membentuk struktur seperti cincin yang boleh dikeluarkan dari penyelesaiannya. |
Ringkasan -Ejen Chelating vs Ejen Penggabungan
Ejen chelating dan ejen penyerapan penting dalam aplikasi perindustrian, biologi dan perubatan. Ia juga berguna untuk menghilangkan kekerasan di dalam air. Walaupun agen chelating dan ejen penyerapan melakukan tindakan yang sama dalam sistem, mereka adalah istilah yang berbeza. Perbezaan utama antara ejen chelating dan ejen pengambilan adalah bahawa ejen chelating boleh mengikat dengan ion logam tunggal manakala ejen penyerapan boleh mengikat dengan beberapa ion logam pada satu masa.
Muat turun versi pdf ejen chelating vs ejen penyerapan
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi pdf di sini perbezaan antara ejen chelating dan ejen penyerapan.
Rujukan:
1. Tony Hargreaves. "Ejen Chelating, Sequestrants."Ejen Chelating, Sequestrants | Kejuruteraan360. N.p., n.d. Web. Terdapat di sini. 05 Jun 2017.
2. Mazadul Hasan. "Ejen Penggabungan."LinkedIn Slideshare. N.p., 22 Mei 2014. Web. Terdapat di sini. 05 Jun 2017.
Ihsan gambar:
1. "Metal -EDTA" oleh Smokefootderivative Work: Chamberlain2007 (Talk) - Medta.PNG, Domain Awam) melalui Commons Wikimedia


