Perbezaan antara orbital molekul ikatan dan antibonding
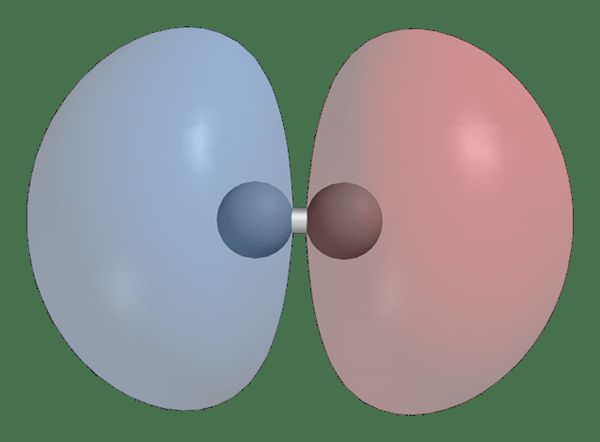
Ikatan vs orbital molekul antibonding
Perbezaan antara orbital molekul ikatan dan antibonding dapat dijelaskan dengan baik menggunakan "teori orbital molekul."Kedua -dua jenis orbital molekul ini terbentuk apabila ikatan kimia kovalen terbentuk. Perbezaan yang paling ketara antara orbital molekul ikatan dan antibonda adalah tahap tenaga mereka berbanding dengan orbital atom induk. Perbezaan tahap tenaga ini membawa kepada perbezaan lain antara dua orbital molekul.
Orbital molekul ikatan dan antibonda dibentuk oleh orbital atom kombinasi linear. Konsep utama berikut sangat penting, untuk memahami perbezaan antara orbital molekul ikatan dan antibonding.
Prinsip Aufbau - Orbital dengan tenaga terendah diisi terlebih dahulu.
Prinsip Pengecualian Pauli - Jumlah maksimum elektron (dengan putaran bertentangan) yang boleh menduduki orbital adalah dua.
Peraturan Hund - Apabila terdapat beberapa orbital molekul dengan tenaga yang sama, elektron menduduki orbital molekul satu demi satu sebelum dua menduduki orbital molekul yang sama.
Apakah orbital molekul ikatan?
Orbital molekul ikatan terbentuk dari orbital atom oleh dalam fasa Gabungan orbital atom. Ia meningkatkan ketumpatan elektron antara atom terikat. Tenaga mereka lebih rendah daripada orbital atom. Elektron mula -mula dipenuhi dengan orbital molekul ikatan dan mereka menstabilkan molekul kerana mereka mengaitkan kurang tenaga daripada elektron dalam atom induk.
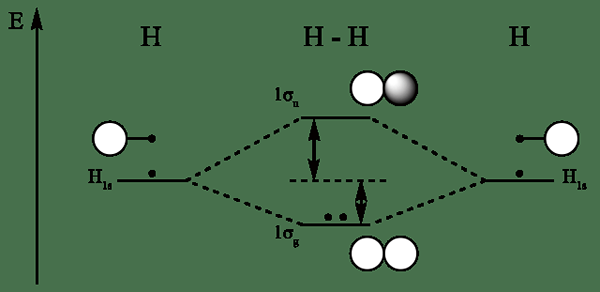
Rajah orbital molekul untuk hidrogen
Apakah orbital molekul antibonda?
Orbital molekul antibonding adalah dibentuk oleh Out-of-fasa Gabungan orbital atom dan ia mengurangkan ketumpatan elektron antara dua atom. Dalam orbital molekul antibonda, tenaga lebih tinggi daripada orbital atom yang membentuknya. Oleh kerana fakta ini, apabila elektron diisi ke dalam orbital molekul antibonding, ia menjejaskan ikatan antara dua atom.

H2 1Sσ* Orbital molekul antibonding
Apakah perbezaan antara orbital molekul ikatan dan orbital molekul antibonding?
• Tenaga:
TenagaOrbital molekul antibonding > TenagaOrbital molekul ikatan
• Orbital molekul ikatan mempunyai tenaga yang lebih rendah berbanding orbital atom induk.
• Orbital molekul antibonding mempunyai tenaga yang tinggi daripada orbital atom induk.
• Secara amnya, elektron mula -mula diisi ke tahap tenaga yang lebih rendah. Oleh itu, elektron mula -mula dipenuhi dengan orbital molekul ikatan dan kemudian ke orbital molekul antibonding.
• Kestabilan:
• Orbital molekul ikatan lebih stabil daripada kedua -dua orbital molekul antibonda dan orbital atom induk.
• Orbital molekul antibonding kurang stabil daripada kedua -dua orbital molekul ikatan dan orbtial atom induk.
• Sebab utama perbezaan kestabilan adalah perbezaan tahap tenaga. Semakin tinggi tenaga kurang kestabilan. Menurunkan tenaga lebih banyak adalah kestabilan.
• Ketersediaan elektron:
• Kebarangkalian mencari elektron sangat tinggi dalam orbital molekul ikatan.
• Mencari elektron dalam orbital molekul antibonding adalah minimum.
• Sumbangan untuk bentuk molekul:
• Orbital molekul ikatan secara langsung menyumbang kepada bentuk molekul.
• Orbital molekul antibonding tidak menyumbang kepada bentuk molekul.
Gambar ihsan:
- MO Diagram Hidrogen oleh CCOIL (CC BY-SA 3.0)
- H2 1Sσ* Orbital molekul antibonding melalui wikicommons (domain awam)


