Perbezaan antara tenaga bon dan tenaga pemisahan bon
The Perbezaan utama antara tenaga ikatan dan tenaga pemisahan ikatan adalah bahawa Tenaga bon adalah nilai purata manakala tenaga pemisahan bon adalah nilai tertentu untuk ikatan tertentu.
Seperti yang dicadangkan oleh ahli kimia Amerika g.N.Lewis, atom stabil apabila mereka mengandungi lapan elektron dalam cangkang valensi mereka. Kebanyakan atom mempunyai kurang daripada lapan elektron dalam kerang valensi mereka (kecuali gas mulia dalam kumpulan 18 jadual berkala); Oleh itu, mereka tidak stabil. Oleh itu, atom -atom ini cenderung bertindak balas antara satu sama lain, menjadi stabil. Ia boleh berlaku dengan membentuk ikatan ionik, ikatan kovalen atau ikatan logam bergantung kepada elektronegativiti atom. Apabila dua atom mempunyai perbezaan elektronegativiti yang sama atau sangat rendah, bertindak balas bersama, mereka membentuk ikatan kovalen dengan berkongsi elektron. Tenaga Tenaga dan Tenaga Pemisahan Bon adalah dua konsep mengenai ikatan kimia kovalen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Tenaga Bon
3. Apakah tenaga pemisahan bon
4. Perbandingan sampingan - tenaga ikatan vs tenaga pemisahan ikatan dalam bentuk jadual
5. Ringkasan
Apa itu Tenaga Bon?
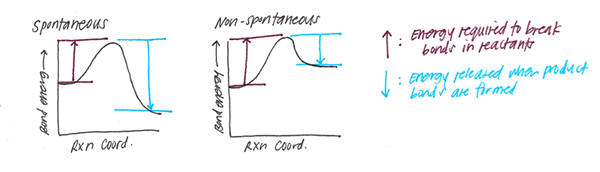
Apabila membentuk bon, beberapa jumlah siaran tenaga. Sebaliknya, pemecahan bon memerlukan sejumlah tenaga. Untuk ikatan kimia tertentu, tenaga ini tetap. Dan kita namakannya sebagai tenaga bon. Oleh itu, tenaga ikatan adalah jumlah haba yang diperlukan untuk memecahkan satu mol molekul ke dalam atom yang sepadan.
Selain itu, kita dapat melihat tenaga ikatan kimia dalam pelbagai bentuk sebagai tenaga kimia, tenaga mekanikal atau tenaga elektrik. Walau bagaimanapun, pada akhirnya, semua tenaga ini berubah menjadi haba. Oleh itu, kita dapat mengukur tenaga ikatan dalam kilojoule atau kilocalorie.

Rajah 01: Tenaga bon
Selanjutnya, tenaga bon adalah penunjuk kekuatan bon. Contohnya, ikatan yang lebih kuat sukar untuk dipegang. Oleh itu, tenaga ikatan mereka lebih besar. Sebaliknya, ikatan yang lemah mempunyai tenaga ikatan kecil, dan mereka mudah dipegang. Tenaga bon juga menunjukkan jarak bon. Tenaga bon yang lebih tinggi bermaksud jarak bon adalah rendah (oleh itu, kekuatan bon adalah tinggi). Tambahan pula, apabila tenaga bon adalah jarak bon yang rendah lebih tinggi. Seperti yang disebutkan dalam pengenalan elektronegativiti memainkan peranan dalam pembentukan bon. Oleh itu, elektronegativiti atom juga menyumbang kepada tenaga ikatan.
Apakah tenaga pemisahan bon?
Tenaga pemisahan bon juga merupakan pengukuran kekuatan bon. Kita boleh menentukannya sebagai perubahan entalpi yang berlaku apabila ikatan mengalami belahan oleh homolisis. Tenaga pemisahan bon khusus untuk satu ikatan.
Dalam kes ini, bon yang sama boleh mempunyai tenaga pemisahan bon yang berbeza bergantung pada keadaan. Sebagai contoh, terdapat empat ikatan C-H dalam molekul metana, dan semua ikatan C-H tidak mempunyai tenaga pemisahan bon yang sama.

Rajah 02: Beberapa tenaga pemisahan bon untuk kompleks koordinasi
Oleh itu, dalam molekul metana, tenaga pemisahan bon untuk bon C-H ialah 439 kJ/mol, 460 kJ/mol, 423 kJ/mol dan 339 kJ/mol. Ini kerana kerosakan bon pertama membentuk spesies radikal melalui homolisis, dengan itu pecah ikatan kedua berlaku dari spesies radikal, yang memerlukan lebih banyak tenaga yang pertama. Begitu juga, langkah demi langkah Tenaga pemisahan bon berubah.
Apakah perbezaan antara tenaga bon dan tenaga pemisahan bon?
Tenaga bon adalah nilai purata tenaga pemisahan bon fasa gas (biasanya pada suhu 298 K) untuk semua bon jenis yang sama dalam spesies kimia yang sama. Walau bagaimanapun, tenaga pemisahan tenaga dan ikatan bon tidak sama. Tenaga pemisahan bon adalah perubahan entalpi standard apabila ikatan kovalen dipotong oleh homolisis untuk memberikan serpihan; yang biasanya spesies radikal. Oleh itu, perbezaan utama antara tenaga bon dan tenaga pemisahan bon ialah tenaga bon adalah nilai purata manakala tenaga pemisahan bon adalah nilai tertentu untuk bon tertentu.
Sebagai contoh, dalam molekul metana, tenaga pemisahan bon untuk bon C-H ialah 439 kJ/mol, 460 kJ/mol, 423 kJ/mol dan 339 kJ/mol. Walau bagaimanapun, tenaga bon c-h metana adalah 414 kJ/mol, yang merupakan purata dari semua empat nilai. Selanjutnya, untuk molekul, tenaga pemisahan bon mungkin tidak semestinya sama dengan tenaga bon (seperti contoh metana yang diberikan di atas). Untuk molekul diatom, tenaga bon dan tenaga pemisahan bon adalah sama.
Di bawah infographic mengenai perbezaan antara tenaga bon dan tenaga pemisahan bon memberikan lebih banyak maklumat mengenai perbezaan.
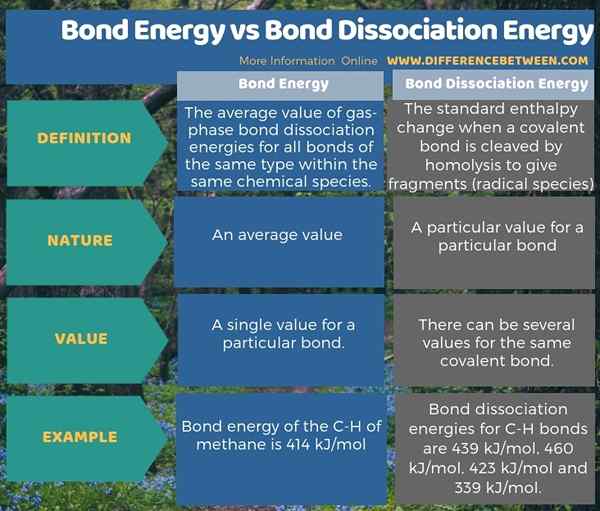
Ringkasan -Tenaga Bon Vs Tenaga Pemisahan Bon
Tenaga pemisahan bon berbeza daripada tenaga bon. Tenaga bon adalah nilai purata semua tenaga pemisahan bon molekul. Oleh itu, perbezaan utama antara tenaga bon dan tenaga pemisahan bon adalah bahawa tenaga bon adalah nilai purata manakala tenaga pemisahan bon adalah nilai tertentu untuk bon tertentu.
Rujukan:
1. "Tenaga pembubaran bon."Wikipedia, Yayasan Wikimedia, 5 Jan. 2019. Terdapat di sini
2. Libretexts. "Tenaga Bond."Kimia Libretexts, Yayasan Sains Kebangsaan, 26 Nov. 2018. Terdapat di sini
Ihsan gambar:
1."Rajah Tenaga Bond" oleh FBarreyro - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2."Tenaga Bon" oleh Chem540f09GRP8 - Kerja sendiri, (Domain Awam) melalui Commons Wikimedia


