Perbezaan antara model bohr dan kuantum
Perbezaan utama - model kuantum bohr vs
Model Bohr dan Model Kuantum adalah model yang menerangkan struktur atom. Model Bohr juga dipanggil model Rutherford-Bohr kerana ia adalah pengubahsuaian model Rutherford. Model Bohr dicadangkan oleh Niels Bohr pada tahun 1915. Model kuantum adalah model moden atom. Perbezaan utama antara model bohr dan kuantum ialah Model Bohr menyatakan bahawa elektron berkelakuan sebagai zarah sedangkan Model kuantum menjelaskan bahawa elektron mempunyai tingkah laku zarah dan gelombang.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu model bohr
3. Apa itu Model Kuantum
4. Perbandingan sampingan - model kuantum bohr vs dalam bentuk jadual
5. Ringkasan
Apa itu model bohr?
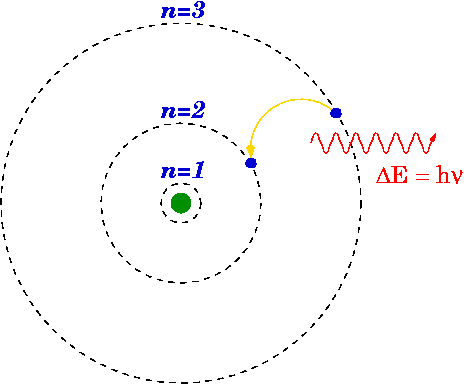
Seperti yang disebutkan di atas, model Bohr adalah pengubahsuaian model Rutherford sejak model Bohr menerangkan struktur atom seperti yang terdiri daripada nukleus yang dikelilingi oleh elektron. Tetapi model Bohr lebih maju daripada model Rutherford kerana ia mengatakan bahawa, elektron selalu bergerak dalam cengkerang tertentu atau orbit di sekitar nukleus. Ini juga menyatakan bahawa cengkerang ini mempunyai tenaga yang berbeza dan bentuk sfera. Yang dicadangkan oleh pemerhatian spektrum garis untuk atom hidrogen.
Oleh kerana kehadiran garis diskret dalam spektrum garis, Bohr menyatakan bahawa orbital atom mempunyai tenaga tetap dan elektron boleh melompat dari satu tahap tenaga ke tenaga yang lain memancarkan atau menyerap tenaga, mengakibatkan garis dalam spektrum garis.
Postulates utama model Bohr
-
Elektron bergerak di sekitar nukleus dalam orbital sfera yang mempunyai saiz dan tenaga tetap.
- Setiap orbit mempunyai jejari yang berbeza dan dinamakan dari nukleus ke luar sebagai n = 1, 2, 3, dll. atau n = k, l, m, dll. di mana n ialah nombor tahap tenaga tetap.
- Tenaga orbital berkaitan dengan saiznya.
- Orbit terkecil mempunyai tenaga terendah. Atom sepenuhnya stabil apabila elektron berada di tahap tenaga terendah.
- Apabila elektron bergerak di orbital tertentu, tenaga elektron itu tetap.
- Elektron boleh bergerak dari satu tahap tenaga ke yang lain dengan menyerap atau melepaskan tenaga.
-
Pergerakan ini menyebabkan sinaran.
Model Bohr sempurna sesuai dengan atom hidrogen yang mempunyai elektron tunggal dan nukleus yang kecil. Selain itu, Bohr menggunakan pemalar papan untuk mengira tenaga tahap tenaga atom.

Rajah 01: Model Bohr untuk hidrogen
Tetapi terdapat beberapa kelemahan model Bohr ketika menjelaskan struktur atom atom selain hidrogen.
Batasan Model Bohr
- Model Bohr tidak dapat menjelaskan kesan zeeman (kesan medan magnet pada spektrum atom).
- Ia tidak dapat menjelaskan kesan tegak (kesan medan elektrik pada spektrum atom).
- Model Bohr gagal menerangkan spektrum atom atom yang lebih besar.
Apa itu Model Kuantum?
Walaupun model kuantum jauh lebih sukar difahami daripada model Bohr, ia menerangkan dengan tepat pemerhatian mengenai atom besar atau kompleks. Model kuantum ini berdasarkan teori kuantum. Menurut teori kuantum, elektron mempunyai dualitas gelombang zarah dan mustahil untuk mencari kedudukan tepat elektron (Prinsip Ketidakpastian). Oleh itu, model ini terutamanya berdasarkan kebarangkalian elektron yang terletak di mana -mana di orbital. Ia juga menyatakan bahawa orbital tidak selalu sfera. Orbital mempunyai bentuk tertentu untuk tahap tenaga yang berbeza dan struktur 3D.
Menurut model kuantum, elektron boleh diberi nama dengan penggunaan nombor kuantum. Empat jenis nombor kuantum digunakan dalam hal ini;
- Nombor kuantum prinsip, n
- Nombor kuantum momentum sudut, i
- Nombor kuantum magnet, mL
- Nombor kuantum putar, ms
The Nombor kuantum prinsip menerangkan jarak purata orbital dari nukleus dan tahap tenaga. The nombor kuantum momentum sudut menerangkan bentuk orbital. The nombor kuantum magnet menggambarkan orientasi orbital di ruang angkasa. The nombor kuantum putaran Memberi spinning elektron dalam medan magnet dan ciri -ciri gelombang elektron.
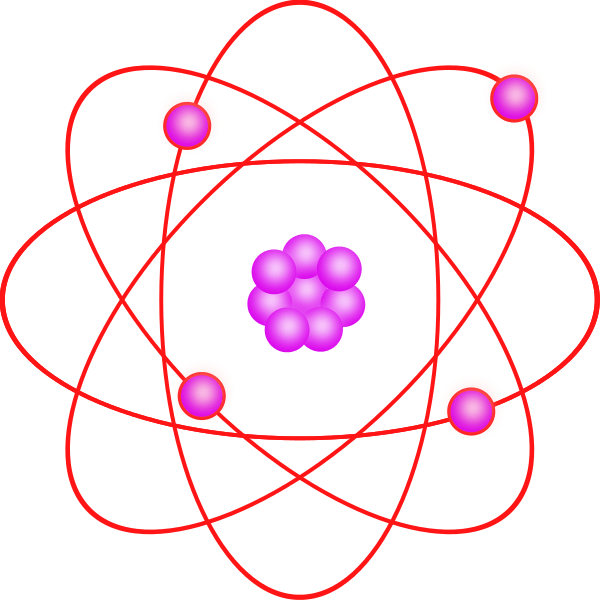
Rajah 2: Struktur spatial orbital atom.
Apakah perbezaan antara model bohr dan kuantum?
Model kuantum bohr vs | |
| Model Bohr adalah model atom yang dicadangkan oleh Niels Bohr (pada tahun 1915) untuk menjelaskan struktur atom. | Model kuantum adalah model atom yang dianggap sebagai model atom moden untuk menjelaskan struktur atom dengan tepat. |
| Tingkah laku elektron | |
| Model Bohr menerangkan tingkah laku zarah elektron. | Model kuantum menerangkan dualitas gelombang-zarah elektron. |
| Aplikasi | |
| Model Bohr boleh digunakan untuk atom hidrogen tetapi bukan untuk atom besar. | Model kuantum boleh digunakan untuk mana -mana atom, termasuk yang lebih kecil dan atom besar, kompleks. |
| Bentuk orbital | |
| Model Bohr tidak menggambarkan bentuk tepat setiap orbit. | Model kuantum menerangkan semua bentuk yang mungkin ada orbital. |
| Kesan elektro-magnet | |
| Model Bohr tidak menjelaskan kesan zeeman (kesan medan magnet) atau kesan tegak (kesan medan elektrik). | Model kuantum menerangkan kesan zeeman dan nyata tepat. |
| Nombor kuantum | |
| Model Bohr tidak menggambarkan nombor kuantum selain daripada nombor kuantum prinsip. | Model kuantum menerangkan semua empat nombor kuantum dan ciri -ciri elektron. |
Ringkasan - model kuantum bohr vs
Walaupun beberapa model atom yang berbeza dicadangkan oleh saintis, model yang paling ketara ialah model Bohr dan model kuantum. Kedua -dua model ini berkait rapat tetapi model kuantum jauh lebih terperinci daripada model Bohr. Menurut model Bohr, elektron bertindak sebagai zarah manakala model kuantum menjelaskan bahawa elektron mempunyai kedua -dua zarah dan tingkah laku gelombang. Ini adalah perbezaan utama antara model bohr dan kuantum.
Muat turun versi pdf model bohr vs kuantum
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi pdf di sini perbezaan antara model bohr dan kuantum.
Rujukan:
1. "Model Bohr Atom | Teori Atom Schrodinger."Kimia. Kelas Byjus, 08 Nov. 2016. Web. Terdapat di sini. 05 Jun 2017.
2. "Struktur atom: model mekanikal kuantum."Dummies. N.p., n.d. Web. Terdapat di sini. 05 Jun 2017.
Ihsan gambar:
1. "Model Bohr Balmer 32" (CC BY-SA 3.0) melalui Commons Wikimedia
2. "Atom Clipart Violet" (Domain Awam) melalui Commons Wikimedia


