Perbezaan antara benzena dan fenil
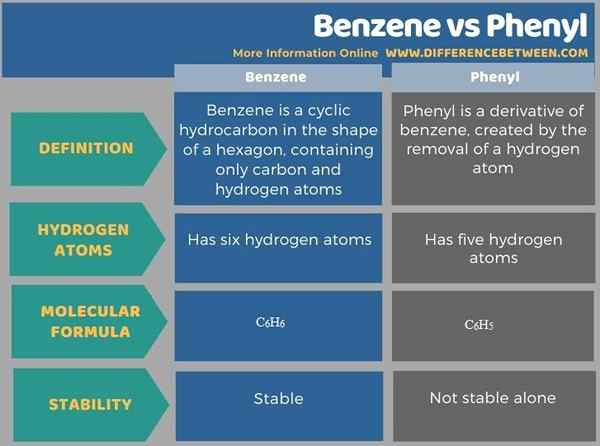
The Perbezaan utama antara benzena dan fenil adalah benzena adalah hidrokarbon kitaran dalam bentuk segi enam, yang mengandungi hanya atom karbon dan hidrogen, sementara fenil adalah terbitan benzena, yang dicipta oleh penyingkiran atom hidrogen. Oleh itu, benzena mengandungi enam atom hidrogen manakala fenil mengandungi lima atom hidrogen.
Benzene adalah hidrokarbon aromatik yang paling mudah dan berfungsi sebagai sebatian induk kepada banyak sebatian aromatik penting. Fenil adalah molekul hidrokarbon dengan formula c6H5. Ia sebenarnya terbitan benzena dan oleh itu, mempunyai sifat yang sama seperti benzena.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu benzena
3. Apa itu fenil
4. Perbandingan sampingan - benzena vs fenil dalam bentuk jadual
5. Ringkasan
Apa itu benzena?
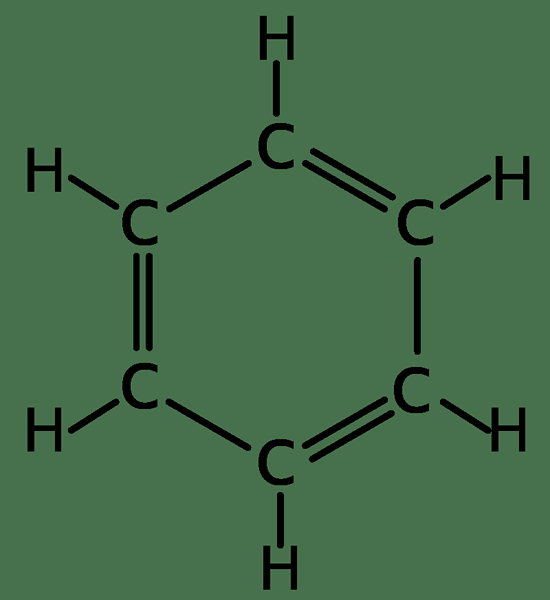
Benzena hanya mempunyai atom karbon dan hidrogen yang diatur untuk memberikan struktur planar. Ia mempunyai formula molekul c6H6. Struktur benzena ditemui oleh Kekule pada tahun 1872. Kerana aromatik, ia berbeza dengan sebatian alifatik.

Strukturnya dan beberapa sifatnya adalah seperti berikut.
Berat Molekul: 78 g Mole-1
Titik mendidih: 80.1 oC
Titik lebur: 5.5 oC
Ketumpatan: 0.8765 g cm-3
Benzene adalah cecair tanpa warna dengan bau manis. Ia mudah terbakar dan menyejat dengan cepat apabila terdedah. Benzena digunakan sebagai pelarut kerana ia dapat membubarkan banyak sebatian bukan polar. Walau bagaimanapun, benzena sedikit larut dalam air. Struktur benzena adalah unik berbanding dengan hidrokarbon alifatik yang lain; Oleh itu, benzena mempunyai sifat unik.
Semua karbon di benzena mempunyai tiga sp2 orbital hibrid. Dua orbital hibrida SP2 bertindih karbon dengan SP2 orbital hibrida karbon bersebelahan di kedua -dua belah pihak. Sp2 tumpang tindih orbit hibrid dengan orbital hidrogen untuk membentuk ikatan σ. Elektron dalam orbital p tumpang tindih karbon dengan elektron P atom karbon di kedua -dua belah pihak, membentuk ikatan PI. Tumpahan elektron ini berlaku di semua enam atom karbon dan, oleh itu, menghasilkan sistem ikatan Pi, yang tersebar di seluruh cincin karbon. Oleh itu, elektron -elektron ini dikatakan diselaraskan. Penyingkiran elektron bermaksud bahawa tidak ada ikatan berganda dan tunggal bergantian. Oleh itu, semua panjang ikatan C-C adalah sama, dan panjangnya antara panjang ikatan tunggal dan berganda. Oleh kerana cincin benzena penyahkawalan stabil, ia enggan menjalani tindak balas tambahan, tidak seperti alkenes lain.
Apa itu fenil?
Fenil adalah molekul hidrokarbon dengan formula c6H5. Ini berasal dari benzena; Oleh itu, ia mempunyai sifat yang sama seperti benzena. Walau bagaimanapun, ini berbeza daripada benzena kerana kekurangan atom hidrogen dalam satu karbon. Oleh itu, berat fenil molekul ialah 77 g mole-1. Phenyl disingkat sebagai pH. Biasanya, fenil dilampirkan pada kumpulan fenil, atom atau molekul lain (bahagian ini dikenali sebagai substituen).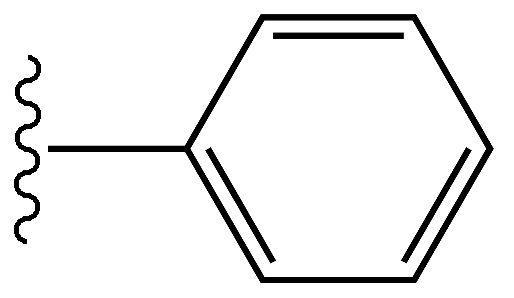
Atom karbon fenil adalah sp2 hibridisasi seperti di benzena. Semua karbon boleh membentuk tiga ikatan sigma. Dua ikatan sigma dibentuk dengan dua karbon bersebelahan sehingga ia akan menimbulkan struktur cincin. Ikatan sigma yang lain dibentuk dengan atom hidrogen. Walau bagaimanapun, dalam satu karbon di gelanggang, ikatan sigma ketiga dibentuk dengan atom atau molekul lain daripada atom hidrogen. Elektron dalam orbital p bertindih antara satu sama lain untuk membentuk awan elektron yang disahpepijat. Oleh itu, fenil mempunyai panjang ikatan C-C yang sama antara semua karbon, tanpa mengira mempunyai ikatan tunggal dan berganda. Panjang ikatan C-C ini adalah kira-kira 1.4 Å. Cincin itu planar dan mempunyai sudut 120o antara bon di sekitar karbon.
Oleh kerana kumpulan fenil substituen, polaritas dan sifat kimia atau fizikal lain berubah. Jika substituen menyumbangkan elektron ke awan elektron yang diselaraskan cincin, mereka dikenali sebagai kumpulan yang membasmi elektron (e.g. -OCH3, NH2). Sekiranya substituen menarik elektron dari awan elektron, ia dikenali sebagai substituen yang mengeluarkan elektron. (E.g. -NO2, -COOH). Kumpulan fenil stabil kerana aromatik mereka, jadi mereka tidak mudah menjalani pengoksidaan atau pengurangan. Selanjutnya, mereka adalah hidrofobik dan bukan kutub.
Apakah perbezaan antara benzena dan fenil?
Pada asasnya, fenil berasal dari benzena. Perbezaan utama antara benzena dan fenil ialah benzena adalah hidrokarbon siklik dalam bentuk segi enam, yang mengandungi hanya karbon dan atom hidrogen, manakala fenil adalah terbitan benzena, yang dicipta oleh penyingkiran atom hidrogen. Selain itu, formula molekul benzena adalah c6H6 Dan, untuk fenil, ia adalah c6H5. Fenil sahaja tidak stabil seperti benzena.
Ringkasan -Benzene vs fenil
Perbezaan utama antara benzena dan fenil ialah benzena adalah hidrokarbon siklik dalam bentuk segi enam, yang mengandungi hanya karbon dan atom hidrogen, manakala fenil adalah terbitan benzena, yang dicipta oleh penyingkiran atom hidrogen.
Ihsan gambar:
1. "Benzene Structural Diagram" oleh Vladsinger - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Kumpulan Radikal Fenil" oleh Samuele Madini - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


