Perbezaan antara ikatan belakang dan menyelaraskan ikatan
The Perbezaan utama antara ikatan belakang dan menyelaras ikatan ialah Ikatan belakang merujuk kepada ikatan kimia yang membentuk antara orbital atom satu atom dan orbital antibonding ligan manakala ikatan menyelaras merujuk kepada perkongsian sepasang elektron antara spesies elektronegatif dan spesies kekurangan elektro.
Menyelaras ikatan biasanya berlaku di kompleks koordinasi di mana atom logam pusat dikelilingi oleh satu set ligan, yang terikat kepada atom logam melalui ikatan koordinat. Di sini, ligan berkongsi pasangan elektron tunggal mereka dengan atom logam. Tetapi, dalam ikatan belakang, ikatan kimia membentuk antara orbital atom satu atom dan orbital antibonding atom lain apabila mereka mempunyai simetri yang setara. Dalam Kimia Organometallic, jenis ikatan kimia ini adalah perkara biasa.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu ikatan belakang
3. Apakah ikatan koordinat
4. Perbandingan sampingan - ikatan belakang vs koordinat ikatan dalam bentuk jadual
5. Ringkasan
Apa itu ikatan belakang?
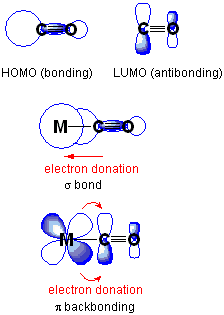
Ikatan belakang atau ikatan pi-back adalah situasi di mana elektron orbital atom satu atom bergerak ke orbit antibonding atom lain, membentuk ikatan kimia. Di sini, kedua -dua bentuk orbital harus mempunyai simetri yang sesuai. Biasanya, atom dengan orbital atom adalah logam peralihan manakala atom dengan orbital antibonding adalah sebahagian daripada ligan pi-penerimaan. Dalam kimia organometallic, jenis ikatan kimia ini adalah perkara biasa, dan ia mempunyai logam peralihan yang dikompleks dengan ligan multiatomik, e.g., karbon monoksida, etilena, ion nitrosonium.

Rajah 01: Derma Kembali
Selain itu, ikatan belakang adalah proses sinergi. Ia melibatkan sumbangan elektron dari orbital yang dipenuhi dengan elektron atau mengandungi pasangan elektron tunggal ke dalam orbital kosong logam peralihan, bersama -sama dengan pembebasan elektron dari orbital d logam menjadi orbital antibonding ligan.
Apakah ikatan koordinat?
Menyelaras ikatan merujuk kepada ikatan kovalen di mana elektron bon bersama disediakan oleh salah satu daripada dua atom dalam ikatan. Maksudnya; Satu atom menyumbangkan salah satu pasangan elektron tunggalnya ke atom lain, dan pasangan elektron tunggal dikongsi antara kedua -dua atom selepas itu. Oleh kerana ia adalah sumbangan, kita boleh menamakannya sebagai ikatan datif atau ikatan dipolar juga.
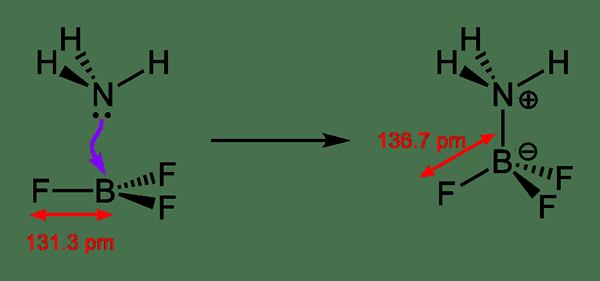
Rajah 02: Proses pembentukan ikatan datif
Apabila melukis struktur kimia, kita dapat menunjukkan ikatan koordinat menggunakan anak panah; Anak panah menunjukkan atom yang menerima elektron dan ekor anak panah bermula dari atom yang menyumbangkan pasangan elektron. Walau bagaimanapun, ia juga merupakan jenis ikatan kovalen; Oleh itu, kami menggantikan anak panah ini dengan garis biasa untuk menunjukkan bahawa ia adalah ikatan di mana pasangan elektron dikongsi. Bon ini biasanya dijumpai di kompleks koordinasi di mana ion logam menerima pasangan elektron tunggal dari ligan.
Apakah perbezaan antara ikatan belakang dan menyelaraskan ikatan?
Ikatan belakang dan koordinat ikatan adalah dua ikatan kovalen yang berbeza. Perbezaan utama antara ikatan belakang dan ikatan menyelaras ialah ikatan belakang merujuk kepada ikatan kimia yang membentuk antara orbital atom satu atom dan orbital antibonding ligan manakala ikatan menyelaras merujuk kepada perkongsian sepasang elektron antara spesies elektronegatif dan spesies kekurangan elektro.
Di bawah seluar infographic perbezaan antara ikatan belakang dan menyelaras ikatan.
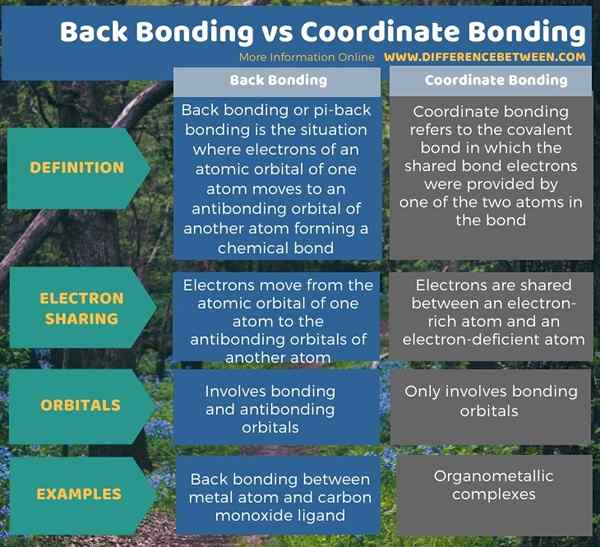
Ringkasan -ikatan belakang vs ikatan koordinat
Ikatan ikatan dan koordinat belakang adalah dua bentuk ikatan kovalen yang berlainan. Perbezaan utama antara ikatan belakang dan ikatan menyelaras ialah ikatan belakang merujuk kepada ikatan kimia yang membentuk antara orbital atom satu atom dan orbital antibonding ligan manakala ikatan menyelaras merujuk kepada perkongsian sepasang elektron antara spesies elektronegatif dan spesies kekurangan elektro.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi bon datif (bon koordinat)."Thoughtco, Oct. 14, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Ikatan Kembali" oleh OMCV - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "NH3-BF3-Adduct-Bond-Leftening-2D" oleh Ben Mills-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


