Perbezaan antara ekonomi atom dan hasil peratusan
Perbezaan utama - Ekonomi Atom vs Peratusan Hasil
Ekonomi atom dan hasil peratusan digunakan untuk menentukan kecekapan sintesis kimia. Penentuan Ekonomi Atom sangat penting kerana memberikan butiran tentang bagaimana prosesnya lebih hijau. Ia juga menunjukkan pembaziran atom semasa proses. Hasil peratusan adalah jumlah produk yang diberikan oleh tindak balas kimia berkenaan dengan jumlah yang diharapkan (jumlah teoritis). Perbezaan utama antara ekonomi atom dan hasil peratusan ialah Ekonomi atom dikira dengan membahagikan jisim molar produk yang dikehendaki oleh jisim molar semua reaktan manakala hasil peratusan dikira dengan menyelam hasil sebenar produk dari hasil teoritis produk.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Ekonomi Atom
3. Apakah hasil peratusan
4. Persamaan antara ekonomi atom dan hasil peratusan
5. Perbandingan sampingan - Atom Ekonomi vs Peratusan Hasil dalam Borang Tabular
6. Ringkasan
Apa itu Ekonomi Atom?
Ekonomi atom atau kecekapan atom adalah penentuan kecekapan sintesis kimia berkenaan dengan atom yang digunakan semasa tindak balas sintesis. Sekiranya ekonomi atom adalah 100%, ini bermakna semua atom yang terlibat dalam proses telah digunakan semasa proses. Ini bermakna semua atom dalam reaktan telah ditukar menjadi atom produk. Sekiranya ekonomi atom proses tinggi, ia dipanggil a proses hijau.
Persamaan untuk pengiraan ekonomi atom
Penentuan ekonomi atom dapat dilakukan melalui persamaan berikut.
Ekonomi atom = (jisim molar yang dikehendaki jisim/molar jisim semua reaktan) x 100%

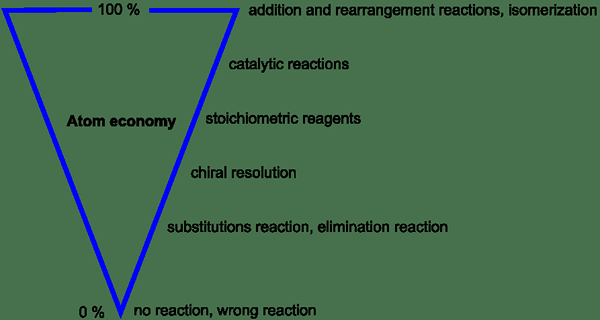
Rajah 1: Variasi ekonomi atom berdasarkan parameter yang berbeza
Dalam proses yang ideal, semua atom dalam reaktan digunakan oleh proses dan ditukar menjadi reaktan. Oleh itu, tiada atom dibazirkan. Tetapi dalam proses sebenar, ekonomi atom lebih rendah daripada 100%. Ini disebabkan oleh pengeluaran produk sampingan dan bukan hanya memberikan produk yang dikehendaki. Ini adalah kebimbangan utama ketika datang ke proses yang menggunakan bahan mentah kos tinggi.
Contoh
Pengeluaran anhydride maleic dari benzena. Ini adalah tindak balas pengoksidaan; Reaktan yang terlibat dalam prosesnya adalah benzena dan oksigen molekul.
Benzene + 4.5oxygen → maleic anhydride + 2carbon dioksida + 2 air
Jisim molar produk yang dikehendaki = (12 × 4) + (16 × 3) + (1 × 2)
= 98 g/mol
Jisim molar semua reaktan; benzena = (12 × 6) + (1 × 6)
= 78 g/mol
Oksigen molekul = 4.5 (16 × 2)
= 144 g/mol
Jumlah jisim reaktan = 78 + 144
= 222 g/mol
Ekonomi Atom = (98/222) x 100%
= 44.14%
Apakah hasil peratusan?
Hasil peratusan (juga dipanggil Hasil peratus) adalah hasil sebenar yang diperolehi daripada tindak balas sintesis kimia, berkenaan dengan hasil teoritis. Nilai diberikan sebagai peratusan. Hasil sebenar adalah apa yang kita peroleh dari eksperimen sedangkan hasil teoritis adalah nilai yang dikira dari persamaan reaksi kimia, memandangkan stoikiometri.
Apabila mengira hasil teoritis, seseorang harus mempertimbangkan reagen yang mengehadkan. Mengehadkan reagen atau mengehadkan reaktan adalah reaktan yang menentukan berapa banyak produk yang telah dibuat. Reaktan yang terhad digunakan semasa tindak balas di mana reaktan lain kekal walaupun selepas selesai reaksi kerana mereka adalah reagen yang berlebihan.
Bagaimana mencari reagen yang mengehadkan?
Ex: Marilah kita pertimbangkan tindak balas antara Al (14 g) dan Cl2 (4.25 g) Gas. Produk akhir adalah ALCL3.
2al+ 3cl2 → 2Alcl3
Mole -mole Al Present = 14/26.98 = 0.52 mol
Tahi lalat cl2 sekarang = 4.25/70.90 = 0.06 mol
Nisbah stoikiometrik antara Al dan Cl2 = 2: 3
Oleh itu, 2 tahi lalat Al bertindak balas dengan 3 tahi lalat Cl2. Maka jumlah cl2 diperlukan untuk bertindak balas dengan 0.52 mol Al Is = (3/2) x 0.52 = 0.78 mol
Tetapi, hanya 0.06 mol hadir. Oleh itu, Cl2 adalah reagen yang mengehadkan di sini. Maka hasil teoritis dikira menggunakan jumlah AL yang ada dalam campuran tindak balas.
Hasil teoritis = (2/3) x 0.06 x 133.3 = 5.33 g
Sekiranya hasil sebenar yang diperoleh dari eksperimen diberikan sebagai 4.33g, maka hasil peratusan dapat dikira seperti berikut.
Hasil peratusan = (4.33/5.33) x 100% = 81.24%
Apakah persamaan antara ekonomi atom dan hasil peratusan?
- Kedua -dua ekonomi atom dan hasil peratusan adalah peratusan.
- Kedua -dua ekonomi atom dan hasil peratusan sangat berguna untuk menentukan kecekapan proses kimia.
Apakah perbezaan antara ekonomi atom dan hasil peratusan?
Atom Ekonomi vs Hasil Peratusan | |
| Ekonomi atom adalah penentuan kecekapan sintesis kimia berkenaan dengan atom yang digunakan semasa tindak balas sintesis. | Hasil peratusan adalah hasil sebenar yang diperolehi daripada tindak balas sintesis kimia, berkenaan dengan hasil teoritis. |
| Tujuan | |
| Ekonomi atom dikira untuk menganggarkan kecekapan proses dan menentukan pembaziran atom. | Hasil peratusan dikira untuk menentukan jumlah produk yang diberikan secara praktikal jika dibandingkan dengan jangkaan teoritis. |
| Pengiraan | |
| Ekonomi atom dikira dengan membahagikan jisim molar produk yang dikehendaki oleh jisim molar semua reaktan | Hasil peratusan dikira dengan menyelam hasil sebenar produk dari hasil teoritis produk. |
Ringkasan -Ekonomi Atom vs Peratusan Hasil
Ekonomi atom dan hasil peratusan adalah nilai peratusan yang dikira mengenai tindak balas kimia. Perbezaan utama antara ekonomi atom dan hasil peratusan ialah ekonomi atom dikira dengan membahagikan jisim molar produk yang dikehendaki oleh jisim molar semua reaktan manakala hasil peratusan dikira dengan menyelam hasil sebenar produk dari hasil teoritis produk.
Rujukan:
1. "Mengehadkan reagen dan hasil peratus."Akademi Khan, boleh didapati di sini.
2. "Ekonomi Atom."Wikipedia, Yayasan Wikimedia, 28 Feb. 2018, boleh didapati di sini.
Ihsan gambar:
1."Atom Economy v3 en" oleh Astrid 91 - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


