Perbezaan antara alkana dan alken
Perbezaan utama - Alkanes vs Alkenes
Alkanes dan Alkenes adalah dua jenis keluarga hidrokarbon yang mengandungi karbon dan hidrogen dalam struktur molekul mereka. Perbezaan utama antara alkana dan alken adalah struktur kimia mereka; Alkanes adalah hidrokarbon tepu dengan formula molekul umum cnH2n+2 dan alkena dikatakan sebagai kumpulan hidrokarbon tak tepu kerana ia mengandungi ikatan berganda antara dua atom karbon. Mereka mempunyai formula molekul umum cnH2n.
Apa itu Alkanes?
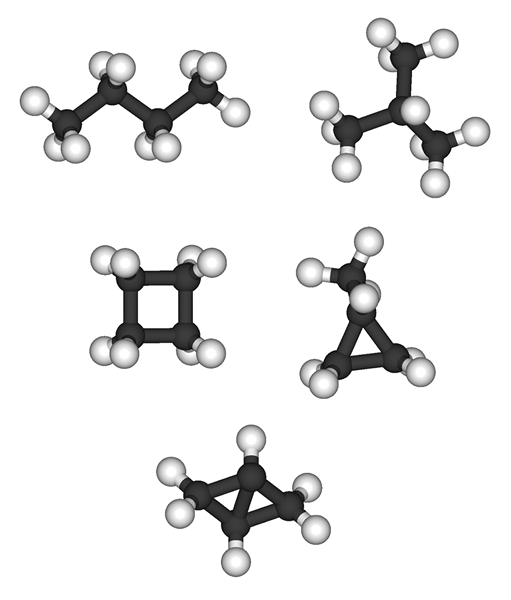
Alkanes hanya mengandungi ikatan tunggal antara atom karbon dan hidrogen (ikatan C-C dan ikatan C-H). Oleh itu, mereka dipanggil "hidrokarbon tepu". Menurut model hibridisasi orbital, semua atom karbon dalam alkena mempunyai SP3 Hibridisasi. Mereka membentuk ikatan sigma dengan atom hidrogen, dan molekul yang dihasilkan mempunyai geometri tetrahedron. Alkanes boleh dibahagikan kepada dua kumpulan mengikut pengaturan molekul mereka; Alkanes Acyclic (CnH2n.+2) dan alkana kitaran (cnH2n).
Apa itu Alkenes?
Alkenes adalah hidrokarbon, yang mengandungi karbon-karbon (c = c) ikatan berganda. "Olefins" adalah nama lama yang digunakan untuk merujuk kepada keluarga alkena. Ahli keluarga terkecil ini ialah Ethane (c2H4); ia dipanggil olefianT gas (dalam bahasa Latin: 'oleum ' bermaksud 'minyak' + 'Facere' bermaksud 'membuat') pada hari -hari awal. Ini kerana tindak balas antara c2H4 dan klorin memberikan c2H2Cl2, minyak.
Apakah perbezaan antara alkana dan alken?
Struktur kimia alkana dan alkena
Alkanes: Alkana mempunyai formula molekul umum cnH2n+2. Metana (ch4) adalah alkana terkecil.
| Nama | Formula kimia | Struktur Acyclic |
| Metana | Ch4 | Ch4 |
| Etana | C2H6 | Ch3Ch3 |
| Propana | C3H8 | Ch3Ch2Ch3 |
| Butana | C4H10 | Ch3Ch2Ch2Ch3 |
| Pentane | C5H12 | Ch3Ch2Ch2Ch2Ch3 |
| Hexane | C6H14 | Ch3Ch2Ch2 Ch2Ch2Ch3 |
| Heptane | C7H16 | Ch3Ch2Ch2Ch2Ch2Ch2Ch3 |
| Octane | C8H18 | Ch3 Ch3Ch2Ch2Ch2Ch2Ch3Ch3 |
Alkenes: Alkenes mempunyai formula kimia umum cnH2n. Alken dianggap sebagai hidrokarbon tak tepu kerana ia tidak mengandungi bilangan maksimum atom hidrogen yang boleh dimiliki oleh molekul hidrokarbon.
| Nama | Formula kimia | Struktur |
| Ethene | C2H4 | Ch2 = Ch2 |
| Propene | C3H6 | Ch3CH = CH2 |
| Butene | C4H8 | Ch2 =Chch2Ch3, Ch3CH = Chch3 |
| Pentene | C5H10 | Ch2 =Chch2Ch2Ch3, Ch3CH = Chch2Ch3 |
| Hexene | C6H12 | Ch2 =Chch2 Ch2Ch2Ch3Ch3CH = Chch2Ch2Ch3 Ch3Ch2Ch=Chch2Ch3 |
| Heptene | C7H14 | Ch=Chch2Ch2Ch2Ch2Ch3Ch3CH = CH2Ch2Ch2Ch2Ch3 |
Sifat Kimia Alkanes dan Alkenes
Alkanes:
Kereaktifan:
Alkanes tidak aktif dengan banyak reagen kimia. Ini kerana ikatan karbon-karbon (C-C) dan karbon-hidrogen (C-H) agak kuat kerana atom karbon dan hidrogen mempunyai nilai elektronegativiti yang sama. Oleh itu, sangat sukar untuk memecahkan ikatan mereka, melainkan jika mereka dipanaskan hingga suhu yang agak tinggi.
Pembakaran:
Alkanes dapat dibakar di udara. Reaksi antara alkana dengan oksigen berlebihan dipanggil "pembakaran". Dalam tindak balas ini, Alkanes menukar karbon dioksida (CO2) dan air.
CnH2n + (n + n/2) o2 → n co2 + NH2O
C4H10 + 13/2 o2 → 4 co2 + 5h2O
Air karbon dioksida oksigen butana
Reaksi pembakaran adalah tindak balas eksotermik (mereka mengeluarkan haba). Akibatnya, alkana digunakan sebagai sumber tenaga.
Alkenes:
Kereaktifan:
Alkenes bertindak balas dengan hidrogen dengan kehadiran pemangkin logam yang dibahagikan halus untuk membentuk alkana yang sepadan. Kadar tindak balasnya sangat rendah tanpa pemangkin.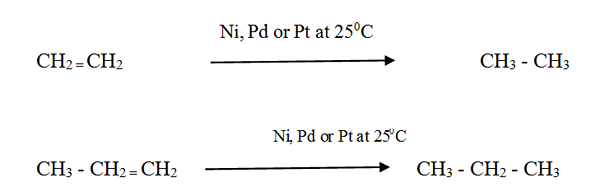
Hidrogenasi pemangkin digunakan dalam industri makanan untuk menukar minyak sayuran cair ke lemak separa pepejal dalam membuat marjerin dan lemak memasak pepejal.
Sifat fizikal Alkanes dan Alkenes
Bentuk
Alkanes: Alkanes wujud sebagai gas, cecair dan pepejal. Metana, etana, propana dan butana adalah gas pada suhu bilik. Struktur unbranched heksana, pentane dan heptane adalah cecair. Alkana yang mempunyai berat molekul yang lebih tinggi adalah pepejal.
Ch4 ke c4H10 adalah gas
C5H12 ke c17H36 adalah cecair, dan
Alkana dengan berat molekul yang lebih tinggi adalah pepejal lembut
Alkenes: Alkenes menunjukkan sifat fizikal yang serupa dengan alkana yang sepadan. Alken yang mempunyai berat molekul yang lebih rendah (c2H4 TOC4H8) adalah gas pada suhu bilik dan tekanan atmosfera. Alkenes mempunyai berat molekul yang lebih tinggi adalah pepejal.
Kelarutan:
Alkanes: Alkanes tidak larut dalam air. Mereka dibubarkan dalam pelarut organik bukan polar atau lemah.
Alkenes: Alkenes adalah molekul kutub kerana ikatan C = C; Oleh itu, mereka larut dalam pelarut bukan polar atau pelarut polaritas yang rendah. Air adalah molekul kutub dan alkena sedikit larut dalam air.
Ketumpatan:
Alkanes: Ketumpatan alkana lebih rendah daripada ketumpatan air. Nilai ketumpatan mereka hampir 0.7 g ml-1, Memandangkan ketumpatan air sebagai 1.0 g ml-1.
Alkenes: Ketumpatan alkena lebih rendah daripada ketumpatan air.
Mata mendidih:
Alkanes: Titik mendidih alkana yang tidak bercabang lancar meningkat apabila bilangan atom karbon dan berat molekul semakin meningkat. Secara umum, alkana bercabang mempunyai titik mendidih yang lebih rendah berbanding dengan alkana yang tidak bercabang, mempunyai bilangan atom karbon yang sama.
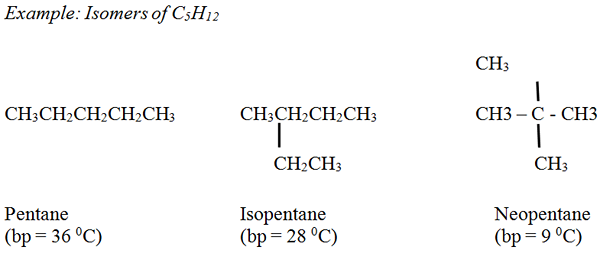
Alkenes: Titik mendidih serupa dengan alkana yang sepadan dengan variasi yang kecil.
Rujukan: Cliffsnotes. (n.d.). Diperoleh pada 06 Julai 2016, dari sini. Zum Directory-Modus. (n.d.). Diperoleh pada 06 Julai 2016, dari sini Polariti. (n.d.). Diperoleh pada 06 Julai 2016, dari sini Dipole Moments. (2013). Diperoleh pada 06 Julai 2016, dari sini Isomer struktur. (n.d.). Diperoleh pada 06 Julai 2016, dari sini Pengenalan kepada Alkenes. (n.d.). Diperoleh pada 06 Julai 2016, dari sini Ihsan gambar: "Nama Alkene" oleh Chris Evans - (CC0) melalui Commons Wikimedia "Hidrokarbon C4 tepu bola-dan-tongkat" oleh Fvasconcellos-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia

