Perbezaan antara adiabatik dan isoterma
The Perbezaan utama antara adiabatik dan isoterma adalah bahawa ADIAbatik bermaksud tidak ada pertukaran haba antara sistem dan sekitar sementara isoterma bermakna tidak ada perubahan suhu.
Untuk tujuan kimia, alam semesta dibahagikan kepada dua bahagian. Bahagian yang kami berminat dipanggil sistem, dan selebihnya dipanggil sekitarnya. Sistem boleh menjadi organisma, kapal tindak balas atau sel tunggal. Sistem ini dibezakan dengan jenis interaksi yang mereka ada atau dengan jenis pertukaran yang berlaku.
Sistem boleh diklasifikasikan menjadi dua sebagai sistem terbuka dan sistem tertutup. Kadang -kadang, perkara dan tenaga dapat ditukar melalui sempadan sistem. Tenaga yang ditukar boleh mengambil beberapa bentuk seperti tenaga ringan, tenaga haba, tenaga bunyi, dan lain -lain. Sekiranya tenaga sistem berubah kerana perbezaan suhu, kami mengatakan terdapat aliran haba. Adiabatik dan polytropic adalah dua proses termodinamik, yang berkaitan dengan pemindahan haba dalam sistem.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Adiabatik
3. Apa itu Isothermal
4. Perbandingan sampingan - adiabatik vs isotermal dalam bentuk jadual
5. Ringkasan
Apa itu Adiabatik?
Perubahan Adiabatik adalah perubahan yang tidak ada haba yang dipindahkan ke dalam atau keluar dari sistem. Pemindahan haba boleh dihentikan terutamanya dalam dua cara. Salah satunya adalah dengan menggunakan sempadan terlindung termal supaya tiada haba boleh masuk atau keluar. Sebagai contoh, tindak balas yang dijalankan dalam sebotol Dewar adalah adiabatik. Jenis proses adiabatik yang lain berlaku apabila proses berlaku dengan cepat; Oleh itu, tidak ada masa yang tersisa untuk memindahkan haba masuk dan keluar.
Dalam termodinamik, perubahan adiabatik ditunjukkan oleh DQ = 0. Dalam keadaan ini, terdapat hubungan antara tekanan dan suhu. Oleh itu, sistem mengalami perubahan akibat tekanan dalam keadaan adiabatik. Inilah yang berlaku dalam pembentukan awan dan arus konveksi berskala besar. Di ketinggian yang lebih tinggi, terdapat tekanan atmosfera yang lebih rendah. Apabila udara dipanaskan, ia cenderung naik. Kerana tekanan udara luar rendah, bungkusan udara yang semakin meningkat akan cuba berkembang. Apabila berkembang, molekul udara berfungsi, dan ini akan menjejaskan suhu mereka. Itulah sebabnya suhu berkurang apabila naik.
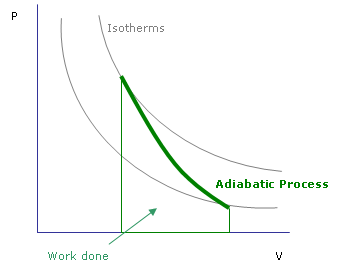
Rajah 01: proses adiabatik
Menurut termodinamik, tenaga dalam bungkusan tetap tetap, tetapi ia dapat ditukar untuk melakukan kerja pengembangan atau mungkin untuk mengekalkan suhunya. Tidak ada pertukaran haba dengan luar. Fenomena yang sama ini juga boleh digunakan untuk pemampatan udara (e.g.: omboh). Dalam keadaan itu, apabila bungkusan udara memampatkan suhu meningkat. Proses ini dipanggil pemanasan dan penyejukan adiabatik.
Apa itu Isothermal
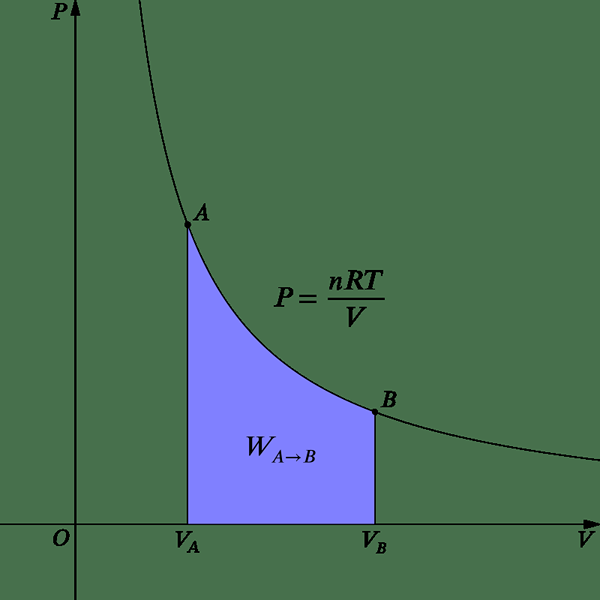
Perubahan isoterma adalah yang mana sistem kekal pada suhu tetap. Oleh itu, dt = 0. Proses boleh menjadi isoterma, jika ia berlaku dengan perlahan dan jika prosesnya boleh diterbalikkan. Jadi, perubahan berlaku dengan sangat perlahan, ada masa yang cukup untuk menyesuaikan variasi suhu. Selain itu, jika sistem boleh bertindak seperti sinki haba, di mana ia dapat mengekalkan suhu malar selepas menyerap haba, ia adalah sistem isoterma.

Rajah 2: Perubahan isoterma
Untuk ideal mempunyai keadaan isoterma, tekanan dapat diberikan dari persamaan berikut.
P = nrt /v
Sejak bekerja, W = PDV Persamaan berikut dapat diperoleh.
W = NRT LN (VF/VI)
Oleh itu, pada suhu malar, pengembangan atau kerja mampatan berlaku semasa menukar jumlah sistem. Oleh kerana tidak ada perubahan tenaga dalaman dalam proses isoterma (du = 0), semua haba yang dibekalkan digunakan untuk melakukan kerja. Inilah yang berlaku dalam enjin haba.
Apakah perbezaan antara adiabatik dan isoterma?
Adiabatik bermaksud tidak ada pertukaran haba antara sistem dan sekitarnya, oleh itu, suhu akan meningkat jika ia adalah mampatan, atau suhu akan berkurangan dalam pengembangan. Sebaliknya, cara isoterma, tiada perubahan suhu; Oleh itu, suhu dalam sistem adalah malar. Ini diperoleh dengan mengubah haba. Dalam adiabatik dq = 0, tetapi dt ≠ 0. Walau bagaimanapun, dalam perubahan isotermal dt = 0 dan dq ≠ 0. Jadi, ini adalah perbezaan utama antara adiabatik dan isoterma. Selain itu, perubahan adiabatik berlaku dengan cepat, sedangkan perubahan isoterma berlaku dengan sangat perlahan.
Di bawah info-grafik meringkaskan perbezaan antara adiabatik dan isoterma.
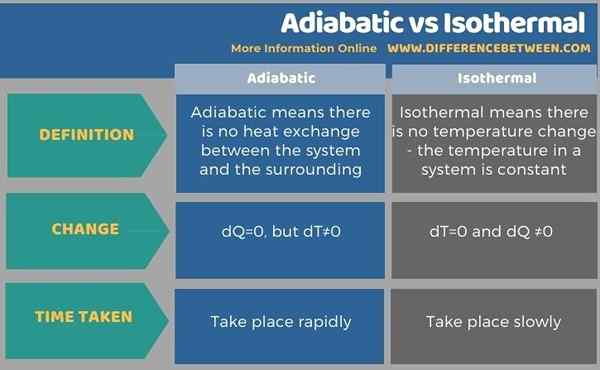
Ringkasan -Adiabatik vs isotermal
Perbezaan utama antara adiabatik dan isoterma adalah bahawa cara adiabatik tidak ada pertukaran haba antara sistem dan sekitar sementara isoterma bermakna tidak ada perubahan suhu.
Ihsan gambar:
1. "Adiabatik" (CC BY-SA 3.0) melalui Commons Wikimedia
2. "Proses Isothermal" oleh Netheril96 - Kerja Sendiri (CC0) melalui Commons Wikimedia


