Perbezaan antara garam berasid dan garam asas

The Perbezaan utama antara garam berasid dan garam asas ialah Garam berasid membentuk penyelesaian yang kurang daripada pH 7.0 Apabila dibubarkan di dalam air, sedangkan garam asas membentuk penyelesaian yang lebih tinggi daripada pH 7.0 Apabila dibubarkan di dalam air.
Garam adalah sebatian ionik yang mengandungi kation dan anion. Ia adalah sebatian pepejal yang tidak mempunyai caj bersih kerana kation dan anion menggabungkan satu sama lain dengan cara yang caj elektrik kation seimbang dengan anion. Bergantung pada komposisi ionik garam, sifat dan kereaktifan dapat ditentukan. Oleh itu, kita boleh mengkategorikan garam menjadi tiga kumpulan sebagai garam berasid, garam asas dan garam neutral.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu garam berasid
3. Apa itu garam asas
4. Perbandingan sampingan - garam berasid vs garam asas dalam bentuk jadual
5. Ringkasan
Apa itu garam berasid?
Garam berasid adalah sebatian ionik yang boleh membentuk penyelesaian berasid apabila pembubaran di dalam air. Maksudnya; Garam berasid membentuk larutan berair yang kurang daripada pH 7.0. Ini berlaku sama ada kerana kehadiran kation logam yang boleh bertindak balas sebagai asid Lewis atau disebabkan oleh kehadiran proton hidrolisis. Paling biasa, garam berasid mengandungi proton hidrolisis. Proton hidrolisis ini mungkin wujud dalam kation atau anion.
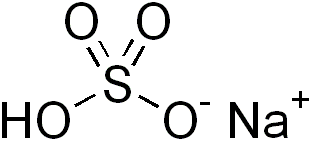
Rajah 01: Natrium bisulfite adalah garam berasid
Proton hidrolisis dalam kation
Garam berasid yang mengandungi kation dengan proton hidrolisis adalah terutamanya ion ammonium. Ion ammonium berasal dari garam ammonium. Selain itu, proton hidrolisis ini boleh berlaku dalam sebatian organik yang mengandungi kumpulan amina protonasi. E.g. ion ammonium, metil ammonium ion, ion etil ammonium, ion anilinium, dll.
Proton hidrolisis dalam anion
Garam berasid mungkin mengandungi proton hidrolisis dalam anion. Contohnya termasuk ion bisulfite, dihydrogen sitrat, ion bioksalasi, dll. Anion ini mengandungi proton yang lemah dipisahkan ke dalam air.
Apa itu garam asas?
Garam Asas adalah sebatian ionik yang boleh membentuk penyelesaian asas apabila pembubaran di dalam air. Maksudnya; Garam ini boleh membentuk larutan berair yang mempunyai pH lebih tinggi daripada 7.0. Umumnya, garam asas boleh menghilangkan molekul air dan membentuk ion hidroksida yang boleh menyebabkan asas dalam larutan berair.

Rajah 02: Natrium sulfida adalah garam asas
Beberapa contoh garam asas termasuk natrium bikarbonat, kalsium karbonat, natrium asetat, kalium sianida, dan natrium sulfida. Garam ini boleh bertindak balas dengan air, memaksa molekul air untuk mengeluarkan ion hidroksida.
Apakah perbezaan antara garam berasid dan garam asas?
Perbezaan utama antara garam berasid dan garam asas ialah garam berasid membentuk penyelesaian yang kurang daripada pH 7.0 Apabila dibubarkan di dalam air, sedangkan garam asas membentuk penyelesaian yang lebih tinggi daripada pH 7.0 Apabila dibubarkan di dalam air. Garam ammonium, natrium bisulfite, dan kalsium oksalat adalah beberapa contoh garam berasid, manakala natrium bikarbonat, kalsium karbonat, natrium asetat, kalium sianida, dan natrium sulfida adalah beberapa contoh garam asas.
Di bawah infographic meringkaskan perbezaan antara garam berasid dan garam asas.
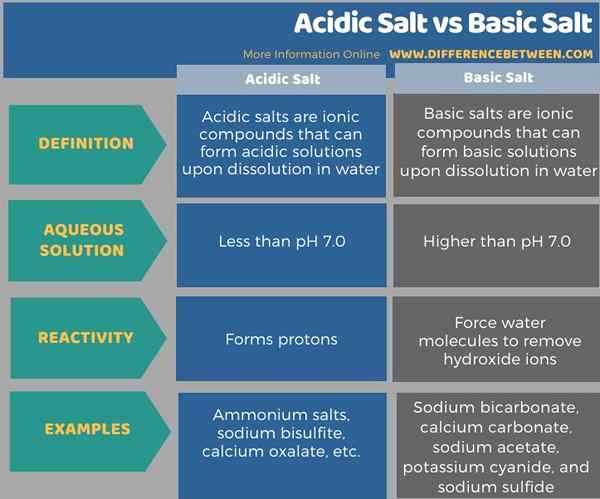
Ringkasan -Garam berasid vs garam asas
Bergantung pada komposisi ionik garam, sifat dan kereaktifan dapat ditentukan. Oleh itu, kita boleh mengkategorikan garam menjadi tiga kumpulan sebagai garam berasid, garam asas dan garam neutral. Perbezaan utama antara garam berasid dan garam asas ialah garam berasid membentuk penyelesaian yang kurang daripada pH 7.0 Apabila dibubarkan di dalam air, sedangkan garam asas membentuk penyelesaian yang lebih tinggi daripada pH 7.0 Apabila dibubarkan di dalam air.
Rujukan:
1. "Sifat asid garam."Kimia Boundless" Lumen, boleh didapati di sini.
2. "7.8: Sifat asid garam."Kimia Libreetexts, Libretexts, 3 Jun 2019, boleh didapati di sini.
3. "Garam Asid."Wikipedia, Yayasan Wikimedia, 17 Okt. 2019, boleh didapati di sini.
Ihsan gambar:
1. "Sodium Bisulfate" oleh Edgar181 - Kerja Sendiri, Domain Awam) melalui Commons Wikimedia
2. "Natrium Sulfida Nonahydrate Crystals" oleh Leiem - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


