Apakah perbezaan antara orbital molekul sigma dan pi
The Perbezaan utama antara orbital molekul sigma dan pi Adakah bentuk orbital molekul sigma dari tumpang tindih orbital atom dalam arah kepala ke kepala di sepanjang paksi internuclear, sedangkan orbital molekul Pi terbentuk dari tumpang tindih orbital atom dalam arah selari.
Orbital molekul sigma dan pi adalah dua jenis orbital molekul yang menyumbang kepada struktur sebenar sebatian kimia. Orbital molekul bertanggungjawab untuk pembentukan ikatan tunggal dan berganda atau tiga.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah orbital molekul
3. Apakah orbital molekul sigma
4. Apakah orbital molekul pi
5. Orbital molekul sigma vs pi dalam bentuk jadual
6. Ringkasan - Orbital molekul Sigma vs PI
Apakah orbital molekul?
Atom bergabung bersama untuk membentuk molekul. Apabila dua atom bergerak lebih dekat bersama untuk membentuk molekul, orbital atom bertindih dan bergabung menjadi orbital molekul. Bilangan orbital molekul yang baru terbentuk adalah sama dengan bilangan orbital atom gabungan. Tambahan pula, orbital molekul mengelilingi kedua -dua nukleus atom, dan elektron dapat bergerak di sekitar kedua -dua nukleus. Sama dengan orbital atom, orbital molekul maksimum mengandungi 2 elektron, yang mempunyai putaran bertentangan.
Selain itu, terdapat dua jenis orbital molekul sebagai orbital molekul ikatan dan orbital molekul antibonding. Orbital molekul ikatan mengandungi elektron dalam keadaan tanah, sementara orbital molekul antibonda tidak mengandungi elektron di keadaan tanah. Tambahan pula, elektron boleh menduduki orbital antibonda jika molekul berada dalam keadaan teruja.
Apakah orbital molekul sigma?
Orbital molekul sigma adalah jenis orbital hibrid yang terbentuk dari tumpang tindih dua orbital atom dari kepala ke kepala di sepanjang paksi internuclear. Biasanya, ikatan kovalen pertama antara dua atom selalu menjadi ikatan sigma. Bertindih dari dua orbital atom dalam paksi antara nuklear membentuk ikatan kovalen sigma. Dalam orbital molekul sigma, ketumpatan elektron di tengah -tengah orbital molekul adalah tinggi jika kedua -dua atom dari mana orbital atom bertindih adalah sama.

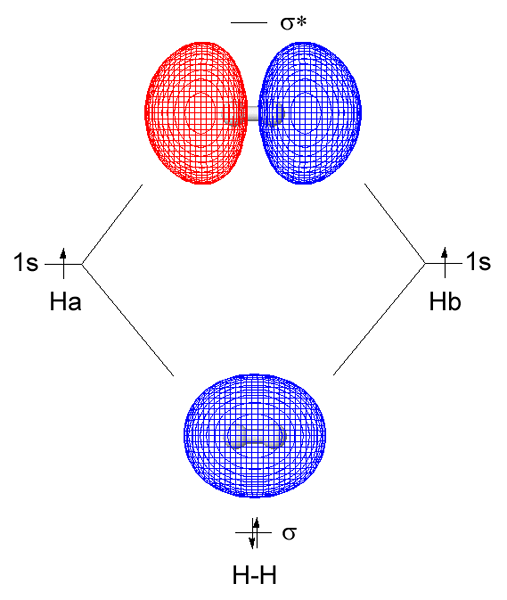
Rajah 01: molekul hidrogen
Apabila mempertimbangkan hidrogen sebagai contoh, bentuk orbital molekul sigma dari tumpang tindih dua orbital atom 1s yang datang dari setiap atom hidrogen. Kita boleh menyingkat ikatan sigma ini sebagai σ. Di sini, ketumpatan elektron bersama berlaku secara langsung antara atom ikatan di sepanjang paksi ikatan. Ini menjadikan interaksi yang lebih stabil antara dua atom terikat bersama dengan elektron ikatan berbanding dengan kestabilan atom yang berasingan. Biasanya, ikatan sigma adalah ikatan pertama yang membentuk antara dua atom.
Apakah orbital molekul pi?
Orbital molekul pi adalah jenis orbital hibrid yang terbentuk dari tumpang tindih dua orbital atom ke arah selari. Di sini, ketumpatan elektron ikatan berlaku di atas dan di bawah paksi internuclear. Selanjutnya, kita tidak dapat memerhatikan elektron di paksi ikatan. Interaksi jenis ini antara dua atom membentuk susunan yang lebih stabil daripada kestabilan atom bebas yang dipisahkan. Biasanya, elektron cenderung untuk menduduki orbital molekul jenis ini apabila elektron yang cukup terdapat di atom. Orbital molekul PI selalu terbentuk sebagai pembentukan orbit molekul kedua atau ketiga mengenai ikatan dua atom kerana orbital molekul sigma adalah ikatan molekul pertama yang terbentuk antara dua atom.
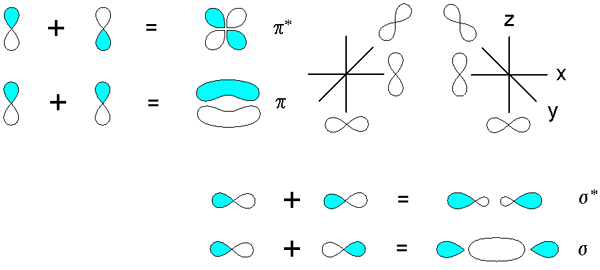
Rajah 02: Orbital molekul PI
Selain itu, bilangan atom yang menyumbang kepada orbital atom P sistem PI sentiasa sama dengan bilangan orbital molekul PI yang terdapat dalam ikatan kimia. Biasanya, orbital molekul Pi terendah mempunyai nod menegak sifar yang ada. Di sini, orbital molekul pi berturut -turut mendapat satu nod menegak tambahan apabila meningkatkan tenaga. Kita boleh menyingkat orbital molekul pi sebagai π.
Apakah perbezaan antara orbital molekul sigma dan pi?
Orbital molekul sigma dan pi adalah dua jenis orbital molekul yang menyumbang kepada struktur sebenar sebatian kimia. Perbezaan utama antara orbital molekul sigma dan pi adalah bahawa bentuk orbital molekul sigma dari tumpang tindih orbital atom ke arah kepala ke kepala di sepanjang paksi internuklear, manakala orbital molekul Pi terbentuk dari tumpang tindih atom atom dalam arah selari.
Infographic berikut menyenaraikan perbezaan antara orbital sigma dan pi molekul dalam bentuk tabular untuk perbandingan sampingan.
Ringkasan -Orbital molekul Sigma vs PI
Orbital molekul adalah jenis orbital yang terbentuk dari tumpang tindih orbital atom. Perbezaan utama antara orbital molekul sigma dan pi adalah bahawa bentuk orbital molekul sigma dari tumpang tindih orbital atom ke arah kepala ke kepala di sepanjang paksi internuklear, manakala orbital molekul Pi terbentuk dari tumpang tindih atom atom dalam arah selari.
Rujukan:
1. "Apakah orbital molekul sigma?" Byjus, 24 dec. 2020.
1. "15.3: orbital molekul pi benzena." Kimia Libreetexts, Libretexts, 14 Julai 2020.
Ihsan gambar:
1. "Molekul Hidrogen" oleh Chiraljon (CC oleh 2.0) melalui Flickr
2. "MO Diagram Pi Orbitals" oleh V8rik di EN.Wikipedia (CC BY-SA 3.0) melalui Commons Wikimedia


