Apakah perbezaan antara asid protik dan asid lewis
The Perbezaan utama antara asid protik dan asid Lewis Adakah asid protik adalah penderma proton, sedangkan asid Lewis adalah penerima proton.
Asid protik adalah sebatian kimia yang dapat menghasilkan proton atau ion hidronium dalam larutan mereka dengan melepaskan proton. Asid Lewis adalah sebatian kimia yang dapat menerima pasangan elektron dari spesies kimia yang membatalkan elektron.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Asid Protik
3. Apa itu asid Lewis
4. Asid protik vs asid lewis dalam bentuk jadual
5. Ringkasan - Asid Protik vs Lewis Asid
Apa itu Asid Protik?
Asid protik adalah sebatian kimia yang boleh menghasilkan proton atau ion hidronium dengan melepaskan proton. Pelepasan proton ini berlaku kerana asid ini dapat menerima sepasang elektron dari oh dalam air dengan bertindak sebagai asid Lewis, tetapi ia tidak dapat menghasilkan ion hidronium atau proton dengan sendirinya.
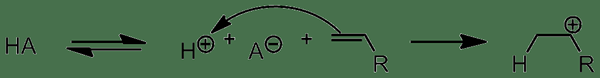
Rajah 01: Tindakan asid protik
Terdapat tiga jenis utama asid protik sebagai asid monoprotik, asid poliprotik, dan asid diprotik . Asid monoprotik dapat melepaskan satu proton ke penyelesaian, sementara asid diprotik dapat melepaskan dua proton. Sebaliknya, asid poliprotik dapat melepaskan lebih dari dua proton. Dalam asid poliprotik, proton dibebaskan dalam beberapa langkah. Walau bagaimanapun, proton pertama hilang dari asid lebih mudah daripada proton seterusnya.
Apa itu asid Lewis?
Asid Lewis adalah sebatian kimia yang dapat menerima pasangan elektron dari spesies kimia yang membatalkan elektron. Jenis sebatian berasid ini mengandungi orbital kosong yang dapat menerima pasangan elektron dari pangkalan Lewis, membentuk tambahan Lewis. Sebaliknya, pangkalan Lewis adalah spesies kimia yang mempunyai orbital yang penuh dengan pasangan elektron. Pasangan elektron ini tidak mengambil bahagian dalam ikatan, tetapi ia boleh membentuk ikatan datif dengan asid Lewis untuk membentuk penambahan Lewis.

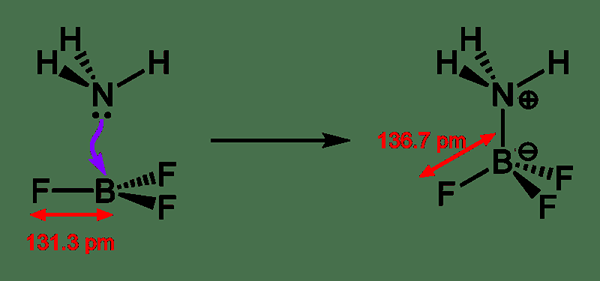
Rajah 02: Pembentukan Lewis Adduct
Biasanya, istilah asid lewis hanya digunakan dengan sebatian kimia planar trigonal yang mengandungi orbital p kosong. Di sana, kita boleh merawat sebatian kompleks seperti Et3al2Cl3 sebagai sebatian planar trigonal yang boleh dinamakan asid Lewis. Selain daripada pembentukan Lewis Adducts, tindak balas lain yang melibatkan asid Lewis dikenali sebagai tindak balas asid-catalyzed. Kadang -kadang, kita menjumpai sebatian kimia seperti H2O yang mempunyai sifat asas Lewis dan Lewis. Ini kerana sebatian ini boleh menderma atau menerima pasangan elektron, bergantung kepada tindak balas kimia di mana mereka terlibat.
Terdapat pelbagai asid Lewis. Asid Lewis yang paling mudah cenderung bertindak dengan mudah dan langsung dengan pangkalan Lewis. Asid Lewis yang paling biasa cenderung menjalani tindak balas kimia sebelum pembentukan penambahan. Beberapa contoh untuk asid Lewis termasuk ion onium seperti ion ammonium dan ion hidronium, kation logam seperti ion ferrik, spesies planar trigonal seperti BF3, sistem PI miskin elektron seperti enones, dan lain-lain. Tiga jenis utama asid Lewis termasuk asid Lewis yang mudah, asid Lewis kompleks dan asid H+ Lewis. Penggunaan asid Lewis yang paling biasa ialah alkilasi Friedel-Crafts.
Apakah perbezaan antara asid protik dan asid lewis?
Kita dapat membezakan asid protik dari asid Lewis melalui tindakan pelepasan proton dari sebatian asid. Perbezaan utama antara asid protik dan asid lewis ialah asid protik adalah penderma proton, sedangkan asid Lewis adalah penerima proton.
Infographic berikut membentangkan perbezaan antara asid protik dan asid lewis dalam bentuk tabular.
Ringkasan -Asid Protik vs Lewis Asid
Kesimpulannya, asid protik berbeza daripada asid Lewis bergantung kepada keupayaan sebatian ini untuk melepaskan proton kepada penyelesaiannya. Perbezaan utama antara asid protik dan asid lewis ialah asid protik adalah penderma proton, sedangkan asid Lewis adalah penerima proton.
Rujukan:
1. "Asid dan pangkalan poliprotik." Kimia Libreetexts, Libretexts, 15 Ogos. 2020.
Ihsan gambar:
1. "Inisiasi Asid Protik" oleh Matchem121 - Kerja Sendiri (CC oleh 3.0) melalui Commons Wikimedia
2. "NH3-BF3-Adduct-Bond-Leftening-2D" oleh Ben Mills-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


