Apakah perbezaan antara perencatan yang tidak kompetitif dan allosteric
The Perbezaan utama antara perencatan yang tidak kompetitif dan allosteric adalah bahawa dalam perencatan yang tidak kompetitif, kadar maksimum tindak balas yang dipangkin (Vmax) berkurangan dan kepekatan substrat (km) kekal tidak berubah, sementara dalam perencatan allosteric, Vmax kekal tidak berubah dan km meningkat.
Enzim adalah penting untuk kebanyakan reaksi yang berlaku dalam organisma. Biasanya, enzim memangkinkan tindak balas dengan mengurangkan tenaga pengaktifan yang diperlukan untuk reaksi. Tetapi enzim harus dikawal dengan teliti untuk mengawal tahap produk akhir yang meningkat ke tahap yang tidak diingini. Ia dikawal oleh perencatan enzim. Inhibitor enzim adalah molekul yang mengganggu laluan tindak balas normal antara enzim dan substrat.
Tapak aktif adalah rantau enzim di mana substrat mengikat dan menjalani tindak balas kimia. Tapak allosteric adalah di mana ia membolehkan molekul sama ada mengaktifkan atau menghalang aktiviti enzim. Kinetik enzim memainkan peranan penting semasa perencatan enzim. Kadar maksimum ciri tindak balas enzim tertentu pada kepekatan tertentu dikenali sebagai halaju maksimum atau vmax. Kepekatan substrat yang memberikan kadar yang separuh daripada vmax adalah km.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah perencatan yang tidak kompetitif
3. Apakah perencatan allosteric
4. Persamaan - Perencatan yang tidak kompetitif dan allosteric
5. Tidak kompetitif vs perencatan allosteric dalam bentuk jadual
6. Ringkasan - Perencatan allosteric tidak kompetitif
Apakah perencatan yang tidak kompetitif?
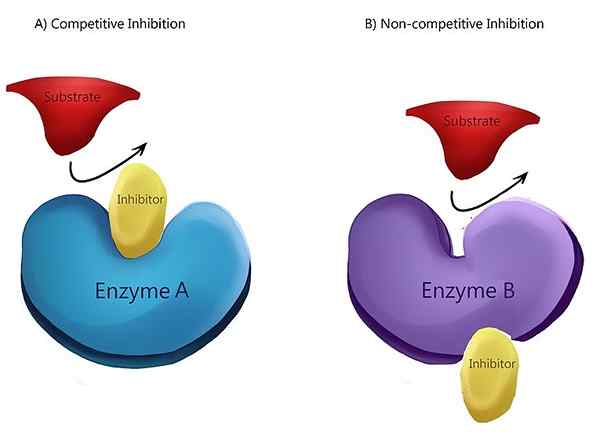
Perencatan yang tidak kompetitif adalah sejenis perencatan enzim di mana perencat mengurangkan aktiviti enzim dan mengikat sama dengan enzim, sama ada ia terikat kepada substrat atau tidak. Dalam erti kata lain, perencatan yang tidak kompetitif adalah di mana perencat dan substrat kedua-duanya mengikat enzim pada bila-bila masa. Apabila kedua-dua substrat dan inhibitor mengikat dengan enzim, ia membentuk kompleks enzim-substrat-inhibitor. Setelah kompleks ini terbentuk, ia tidak dapat menghasilkan produk. Ia hanya boleh menukar kembali ke kompleks enzim-substrat atau kompleks enzim-inhibitor.

Rajah 01: Perencatan yang tidak kompetitif
Dalam perencatan yang tidak kompetitif, perencat mempunyai pertalian yang sama untuk kompleks enzim dan enzim substrat. Mekanisme yang paling biasa bagi perencat yang tidak kompetitif adalah pengikatan yang boleh diterbalikkan dari inhibitor ke tapak allosteric. Tetapi perencat juga mempunyai keupayaan untuk mengikat terus ke tapak aktif. Contoh perencat yang tidak kompetitif adalah penukaran kinase piruvat ke piruvat. Penukaran phosphoenolpyruvate untuk menghasilkan piruvat dipangkin oleh kinase piruvat. Asid amino yang dipanggil alanine, yang disintesis dari piruvat, menghalang kinase piruvat enzim semasa glikolisis. Alanine bertindak sebagai perencat yang tidak kompetitif.
Apakah perencatan allosteric?
Perencatan Allosteric adalah sejenis perencatan enzim di mana perencat melambatkan aktiviti enzim dengan menyahaktifkan enzim dan mengikat enzim di tapak allosteric. Di sini, perencat tidak bersaing secara langsung dengan substrat di tapak aktif. Tetapi, ia secara tidak langsung mengubah komposisi enzim. Setelah bentuknya berubah, enzim menjadi tidak aktif. Oleh itu, ia tidak lagi boleh mengikat dengan substrat yang sepadan. Ini, seterusnya, melambatkan pembentukan produk akhir.
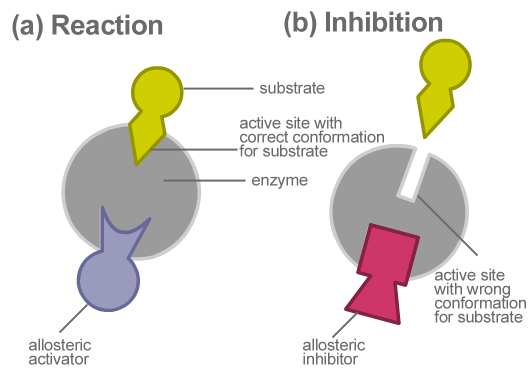
Rajah 02: Perencatan allosteric
Perencatan allosteric menghalang pembentukan produk yang tidak perlu, mengurangkan pembaziran tenaga. Contoh perencatan allosteric adalah penukaran ADP ke ATP dalam glikolisis. Di sini, apabila terdapat ATP yang berlebihan dalam sistem, ATP berfungsi sebagai perencat allosteric. Ia mengikat phosphofructokinase, yang merupakan salah satu enzim yang terlibat dalam glikolisis. Ini melambatkan penukaran ADP. Akibatnya, ATP menghalang pengeluaran yang tidak perlu. Oleh itu, pengeluaran berlebihan ATP tidak diperlukan apabila terdapat jumlah yang mencukupi.
Apakah persamaan antara perencatan yang tidak kompetitif dan allosteric?
- Kedua -dua jenis hambatan enzim melambatkan aktiviti enzim.
- Inhibitor dalam kedua -dua perencatan enzim tidak bersaing dengan substrat di tapak aktif.
- Inhibitor mengubah komposisi enzim secara tidak langsung.
- Kedua -dua inhibitor mengubah bentuk enzim.
Apakah perbezaan antara perencatan yang tidak kompetitif dan allosteric?
Dalam perencatan yang tidak kompetitif, vmax reaksi berkurangan semasa meninggalkan nilai km tidak berubah. Sebaliknya, dalam perencatan allosteric, Vmax kekal tidak berubah, dan nilai km meningkat. Jadi, ini adalah perbezaan utama antara perencatan yang tidak kompetitif dan allosteric. Perencatan Allosteric memberi tumpuan lebih kepada penggunaan bahan kimia yang mengubah aktiviti enzim dengan mengikat di tapak allosteric, sementara inhibitor yang tidak kompetitif selalu menghentikan enzim kerja dengan mengikat secara langsung di tapak alternatif.
Infographic berikut menyusun perbezaan antara perencatan yang tidak kompetitif dan allosteric untuk perbandingan sampingan.
Ringkasan -Perencatan allosteric tidak kompetitif
Perencatan yang tidak kompetitif adalah perencatan enzim di mana perencat mengurangkan aktiviti enzim dan mengikat sama dengan enzim sama ada ia terikat kepada substrat atau tidak. Perencatan Allosteric adalah sejenis perencatan enzim di mana perencat melambatkan aktiviti enzim dengan menyahaktifkan enzim dan mengikat enzim di tapak allosteric. Perbezaan utama antara perencatan yang tidak kompetitif dan allosteric adalah bahawa kadar maksimum tindak balas yang dipangkin (Vmax) dikurangkan, dan kepekatan substrat (km) kekal tidak berubah dalam perencatan yang tidak kompetitif manakala Vmax tetap tidak berubah, dan km meningkat dalam allosterik perencatan.
Rujukan:
1. "Peraturan Allosteric: Protokol."Jove.
2. "Enzim."Mikrobiologi tanpa batas.
Ihsan gambar:
1. "Perencatan Enzim Kompetitif & Tidak Kompetitif" oleh California16 - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Perencatan Allosteric" oleh [[: en: user: 1 | 1]] di bahasa Inggeris bahasa Inggeris (cc by-sa 3.0) melalui Commons Wikimedia


