Apakah perbezaan antara pelarut pelarut dan pembezaan yang membezakan
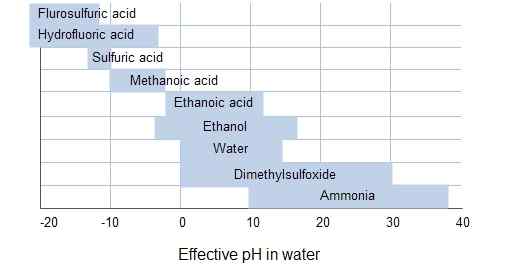
The Perbezaan utama antara pelarut pelarut dan pembezaan yang membezakan adalah bahawa asid sepenuhnya memisahkan ion apabila mereka berada dalam pelarut meratakan, sedangkan asid sebahagiannya memisahkan ion ketika mereka sedang membezakan pelarut.
Kita boleh mengklasifikasikan pelarut ke dalam pelarut meratakan dan membezakan pelarut mengikut kesannya terhadap sifat -sifat asid dan asas, terutamanya kepada kekuatan berasid atau asas spesies kimia tersebut.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu pelarut meratakan
3. Apakah pelarut yang membezakan
4. Pelarut meratakan vs membezakan pelarut dalam bentuk jadual
5. Ringkasan
Apa itu pelarut meratakan?
Pelarut pelarut atau kesan meratakan adalah kesan pelarut pada sifat asid dan pangkalan. Sebagai contoh, kekuatan asid yang kuat boleh dibatasi atau disamakan dengan asas pelarut. Oleh itu, kita dapat mengukur kekuatan asas yang kuat oleh keasidan pelarut.
Biasanya, asid kuat larut dalam air dan membentuk ion hidronium apabila reaksi dengan molekul air. Asid yang lebih kuat daripada ion hidronium dan cenderung bertindak balas dengan molekul air untuk membentuk ion hidronium. Dengan kata lain, asid kuat yang lebih kuat daripada ion hidronium tidak dapat wujud di dalam air. E.g. Asid perchloric berair dapat mengionkan sepenuhnya di dalam air, dan ia adalah asid yang kuat.

Rajah 01: Diskriminasi Asid-Asid
Umumnya, pangkalan yang kuat dianggap sebagai pelarut meratakan untuk asid. Apabila terdapat pelarut meratakan, banyak asid cenderung sepenuhnya memisahkan ion, dan oleh itu, mereka mempunyai kekuatan yang sama. Selain itu, semua asid menjadi tidak dapat dibezakan dalam kekuatan apabila mereka dibubarkan dalam pelarut yang sangat asas kerana pertalian mereka yang lebih besar dari asas yang kuat untuk proton. Kami memanggil fenomena ini kesan meratakan.
Apakah pelarut yang membezakan?
Pelarut yang membezakan adalah pelarut kimia yang menyebabkan pelbagai asid berpisah dengan darjah yang berbeza. Dengan kata lain, asid memisahkan sebahagiannya dalam membezakan pelarut. Oleh itu, asid mempunyai kekuatan yang berbeza apabila mereka berada dalam pelarut ini. E.g. Asid asetik anhydrous adalah pelarut dan penerima proton yang lemah daripada air. Oleh itu, asid kuat seperti asid hidroklorik sebahagiannya memisahkan ion apabila mereka berada dalam jenis pelarut ini. Asid kuat menunjukkan kekuatan yang berbeza apabila mereka berada dalam jenis pelarut ini.
Perbezaan antara pelarut pelarut dan pembezaan
Pelarut meratakan dan pelarut yang membezakan adalah dua jenis pelarut yang dikategorikan mengikut kesannya terhadap sifat -sifat asid dan pangkalan, terutamanya mengikut kekuatan berasid atau asas spesies kimia tersebut. Pelarut pelarut atau kesan meratakan adalah kesan pelarut pada sifat -sifat asid dan pangkalan semasa membezakan pelarut adalah pelarut kimia yang menyebabkan pelbagai asid berpisah dengan darjah yang berbeza. Perbezaan utama antara pelarut pelarut dan pembezaan yang membezakan adalah bahawa asid benar. Selain itu, dalam meratakan pelarut, kekuatan produk yang dipisahkan adalah sama, sedangkan dalam membezakan pelarut, kekuatan produk yang dipisahkan adalah tidak sama rata.
Infographic berikut meringkaskan perbezaan antara pelarut meratakan dan membezakan pelarut dalam bentuk tabular untuk perbandingan sampingan.
Ringkasan -Pelarut meratakan vs pembezaan pelarut
Pelarut meratakan dan pelarut yang membezakan adalah dua jenis pelarut yang dikategorikan mengikut kesannya terhadap sifat asid dan asas, terutamanya kepada kekuatan berasid atau asas spesies kimia tersebut. Perbezaan utama antara pelarut pelarut dan pembezaan yang membezakan adalah bahawa asid benar.
Rujukan:
1. "8.4 kesan pelarut." Kimia Libreetexts, Libretexts, 11 Ogos. 2020.
Ihsan gambar:
1. "Tingkap Diskriminasi Asid Pelarut Biasa" oleh J1812 - Kerja Sendiri (CC0) melalui Commons Wikimedia


