Apakah perbezaan antara peralihan fasa pesanan pertama dan kedua
The Perbezaan utama antara peralihan fasa pesanan pertama dan kedua ialah peralihan fasa pesanan pertama bergantung pada kuasa pertama kepekatan reaktan dalam persamaan kadar, sedangkan peralihan fasa pesanan kedua bergantung pada kuasa kedua kepekatan dalam persamaan kadar.
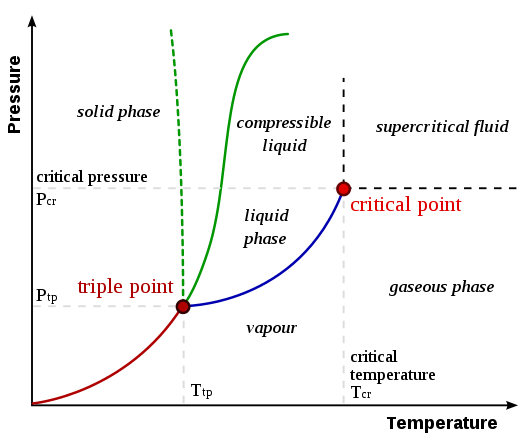
Peralihan fasa adalah perubahan fasa bahan, yang merupakan proses fizikal peralihan keadaan medium ke keadaan yang berbeza dari medium yang sama, yang dikenal pasti oleh parameter seperti ketumpatan dan kelantangan. Umumnya, istilah ini digunakan untuk menggambarkan fasa seperti pepejal, cecair, gas, dan plasma. Jenis peralihan fasa termasuk lebur, mendidih, sublimasi, pengewapan, pengionan, pemendapan, pemeluwapan, dan rekombinasi.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah peralihan fasa pesanan pertama
3. Apakah peralihan fasa pesanan kedua
4. Peralihan fasa pesanan pertama vs kedua dalam bentuk jadual
5. Ringkasan -Peralihan Fasa Perintah Kedua Pertama
Apakah peralihan fasa pesanan pertama?
Peralihan fasa pesanan pertama adalah tindak balas kimia di mana kadar tindak balas bergantung kepada kepekatan molar salah satu reaktan yang terlibat dalam reaksi. Oleh itu, jumlah kuasa yang mana kepekatan reaktan dinaikkan dalam persamaan undang -undang kadar akan selalu 1. Sekiranya reaktan tunggal mengambil bahagian dalam tindak balas ini, kepekatan reaktan tersebut menentukan kadar tindak balas. Tetapi kadang -kadang, terdapat lebih daripada satu reaktan yang mengambil bahagian dalam reaksi ini. Dalam kes sedemikian, salah satu reaktan ini akan menentukan kadar tindak balas.

Kita boleh mencirikan peralihan fasa pesanan pertama oleh ketidakpastian pembolehubah termodinamik, termasuk ketumpatan dan entropi. Selain itu, jenis peralihan ini biasanya dipaparkan oleh perubahan dalam kelantangan.
Apakah peralihan fasa pesanan kedua?
Peralihan fasa pesanan kedua adalah tindak balas kimia di mana kadar tindak balas bergantung kepada kepekatan molar dua reaktan atau kuasa kedua satu reaktan yang terlibat dalam reaksi. Oleh itu, jumlah kuasa yang mana kepekatan reaktan dinaikkan dalam persamaan undang -undang kadar akan selalu menjadi 2. Sekiranya terdapat dua reaktan, kadar tindak balas bergantung kepada kuasa pertama kepekatan setiap reaktan.
Peralihan fasa kedua juga dikenali sebagai peralihan fasa berterusan kerana ia dicirikan oleh kerentanan yang berbeza, kerosakan undang -undang kuasa korelasi berhampiran kritikal, dan lain -lain. Teori di sebalik peralihan fasa urutan kedua telah dibangunkan oleh saintis menggunakan teori Landau.
Apakah perbezaan antara peralihan fasa pesanan pertama dan kedua?
Perintah pertama dan tindak balas pesanan kedua boleh berlaku sebagai peralihan fasa. Perbezaan utama antara peralihan fasa urutan pertama dan kedua ialah peralihan fasa pesanan pertama bergantung kepada kuasa pertama kepekatan reaktan dalam persamaan kadar, sedangkan peralihan fasa pesanan kedua bergantung pada kuasa kedua kepekatan dalam persamaan kadar.
Berikut adalah ringkasan perbezaan antara peralihan fasa pesanan pertama dan kedua dalam bentuk jadual untuk perbandingan bersebelahan.
Ringkasan -Peralihan Fasa Perintah Kedua Pertama
Peralihan fasa pesanan pertama adalah tindak balas kimia di mana kadar tindak balas bergantung kepada kepekatan molar salah satu reaktan yang terlibat dalam reaksi. Reaksi urutan kedua, sebaliknya, adalah tindak balas kimia di mana kadar tindak balas bergantung kepada kepekatan molar dua reaktan atau kuasa kedua satu reaktan yang terlibat dalam reaksi. Perbezaan utama antara peralihan fasa urutan pertama dan kedua ialah peralihan fasa pesanan pertama bergantung kepada kuasa pertama kepekatan reaktan dalam persamaan kadar, sedangkan peralihan fasa pesanan kedua bergantung pada kuasa kedua kepekatan dalam persamaan kadar.
Rujukan:
1. "Peralihan fasa pesanan." Gambaran Keseluruhan | Topik Sciencedirect.
Ihsan gambar:
1. "Fasa-Diag2" oleh Matthieumarechal (CC BY-SA 3.0) melalui Commons Wikimedia


