Apakah perbezaan antara entalpi entalpi dan molar
The Perbezaan utama antara entalpi entalpi dan molar Adakah entalpi adalah jumlah kandungan haba sistem termodinamik, sedangkan entalpi molar adalah jumlah haba per mole reaktan dalam sistem.
Enthalpy dan enthalpy molar adalah istilah berguna dalam kimia fizikal untuk menentukan jumlah kandungan haba dalam sistem termodinamik. Kita dapat menentukan sistem termodinamik sebagai badan bahan atau radiasi yang dikurung oleh dinding yang mempunyai kebolehtelapan tertentu yang dapat memisahkan sistem ini dari sekitarnya.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu entalpi
3. Apa itu entalpi molar
4. Entalpi dan enthalpi molar dalam bentuk jadual
5. Ringkasan - Enthalpy vs entalpi molar
Apa itu entalpi?
Entalpi sistem adalah kuantiti termodinamik yang bersamaan dengan jumlah kandungan haba sistem. Ia sama dengan tenaga dalaman sistem ditambah dengan produk tekanan dan kelantangan. Oleh itu, ia adalah harta termodinamik sistem.
Persamaan entalpi diberikan di bawah.
H = u +pv
Dalam persamaan di atas, h adalah entalpi sistem, u adalah tenaga dalaman sistem, p adalah tekanan, dan v adalah kelantangan. Enthalpy sistem adalah petunjuk keupayaan sistem itu untuk melepaskan haba (untuk melakukan kerja bukan mekanikal). Entalpi dilambangkan oleh simbol h.

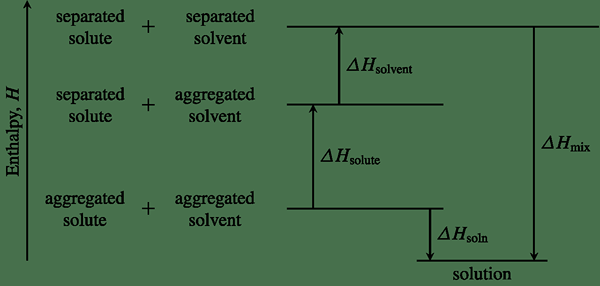
Rajah 01: Rajah entalpi menunjukkan perubahan entalpi untuk tindak balas kimia tertentu
Menentukan entalpi sistem membolehkan kita menunjukkan jika tindak balas kimia adalah eksotermik atau endotermik. Perubahan entalpi sistem boleh digunakan untuk menentukan haba reaksi dan untuk meramalkan jika tindak balas kimia adalah spontan atau tidak spontan.
Apa itu entalpi molar?
Entalpi molar adalah nilai entalpi yang diberikan setiap tahi lalat. Dalam definisi ini, entalpi adalah kuantiti termodinamik bersamaan dengan jumlah kandungan haba sistem. Ia sama dengan tenaga dalaman sistem ditambah dengan produk tekanan dan kelantangan. Unit pengukuran untuk nilai ini adalah kJ/mol. Oleh itu, kita dapat memperoleh persamaan untuk penentuan entalpi molar seperti berikut:
Entalpy molar = dh/n
Di mana DH adalah perubahan entalpi sistem, "n" adalah bilangan tahi lalat reaktan yang terlibat dalam sistem. Sebagai contoh, entalpi molar untuk pembentukan bahan tertentu adalah perubahan entalpi apabila satu mol spesies kimia terbentuk dalam keadaan standard pada suhu yang ditentukan. Pembentukan bahan ini berlaku dari bentuk yang paling stabil dari unsur -unsur kimia konstituen bahan tersebut dalam keadaan standard mereka.
Apakah perbezaan antara entalpi entalpi dan molar?
Enthalpy dan enthalpy molar adalah istilah berguna dalam kimia fizikal untuk menentukan jumlah kandungan haba dalam sistem termodinamik. Perbezaan utama antara entalpi dan entalpi molar ialah entalpi adalah jumlah kandungan haba sistem termodinamik, sedangkan entalpi molar adalah jumlah haba per mole reaktan dalam sistem. Selain itu, unit pengukuran untuk entalpi adalah joules atau kilojoules, sementara unit pengukuran untuk entalpi molar adalah kilojoules per mole.
Jadual berikut meringkaskan perbezaan antara entalpi entalpi dan molar.
Ringkasan -Enthalpy vs entalpi molar
Enthalpy dan enthalpy molar adalah istilah berguna yang membantu menentukan jumlah kandungan haba dalam sistem termodinamik. Entalpi sistem adalah kuantiti termodinamik yang bersamaan dengan jumlah kandungan haba sistem. Entalpi molar adalah nilai entalpi yang diberikan setiap tahi lalat. Oleh itu, perbezaan utama antara entalpi dan entalpi molar ialah entalpi adalah jumlah kandungan haba sistem termodinamik, sedangkan entalpi molar adalah jumlah haba per mole reaktan dalam sistem.
Rujukan:
1. "Entalpi Molar." Gambaran Keseluruhan | Topik Sciencedirect, .
2. "Apa itu entalpi? - Definisi, Reaksi Endotermik & Exothermic."Byju's, 16 Nov. 2020.
3. "Enthalpy." Kimia Libreetexts, Libretexts, 15 Ogos. 2020.
Ihsan gambar:
1. "Enthalpy-Diagram-Pembentukan-Exothermic" oleh Dale J. Brugh - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


