Apakah perbezaan antara interaksi dipole dipole dan ikatan hidrogen
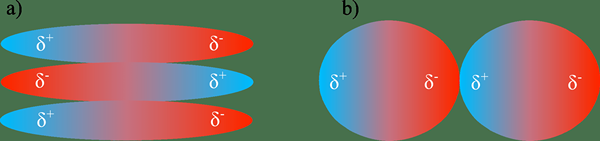
The Perbezaan utama antara interaksi dipole dipole dan ikatan hidrogen Adakah interaksi dipole dipole berlaku apabila molekul yang dikenakan secara negatif berinteraksi dengan molekul jiran dengan caj positif, sedangkan ikatan hidrogen adalah jenis ikatan dipole dipole yang kuat yang berlaku di antara atom O, N, dan F dan H.
Interaksi dipole-dipole dan ikatan hidrogen adalah fenomena yang sangat penting ketika mengkaji ikatan molekul, tingkah laku molekul, struktur kristal, dan banyak fakta kimia lain.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah interaksi dipole dipole
3. Apakah ikatan hidrogen
4. Interaksi dipole dipole vs ikatan hidrogen dalam bentuk jadual
5. Ringkasan -Interaksi dipole dipole vs ikatan hidrogen
Apakah interaksi dipole dipole?
Interaksi dipole-dipole atau daya dipole-dipole adalah daya intermolecular yang berlaku antara molekul kutub. Ini adalah kuasa elektrostatik. Apabila membentuk jenis kuasa ini, molekul kutub cenderung diselaraskan supaya tarikan antara molekul dimaksimumkan dengan mengurangkan potensi tenaga. Penjajaran ini juga mengurangkan penolakan antara molekul.

Apabila mempertimbangkan satu siri sebatian dengan massa molar yang sama (yang mempunyai daya interaksi dipole-dipole antara molekul), kekuatan daya dipole-dipole meningkat apabila polariti meningkat. Yang berlaku kerana pemisahan caj tinggi apabila polariti tinggi. Apabila molekul mempunyai pemisahan caj yang tinggi (terminal positif dan negatif yang sangat dikenakan dalam molekul yang sama), ia cenderung menarik caj yang bertentangan. Ini juga membawa kepada peningkatan dalam titik mendidih sebatian. Lebih besar daya dipole-dipole, semakin besar titik mendidih.
Apakah ikatan hidrogen?
Ikatan hidrogen boleh digambarkan sebagai jenis daya tarikan antara dua atom dua molekul yang berbeza. Ia adalah daya tarikan yang lemah. Walau bagaimanapun, jika dibandingkan dengan jenis daya intramolekul yang lain, seperti interaksi polar polar dan interaksi nonpolar-nonpolar seperti daya vander waal, ikatan hidrogen jauh lebih kuat.
Biasanya, ikatan hidrogen membentuk antara molekul kovalen kutub. Molekul -molekul ini mengandungi ikatan kovalen kutub, yang terbentuk sebagai hasil daripada perbezaan nilai elektronegativiti atom -atom yang berada dalam ikatan kovalen. Sekiranya perbezaan ini tinggi, atom elektronegatif yang sangat cenderung menarik elektron ikatan ke arah dirinya. Oleh itu, ini mewujudkan momen dipole di mana atom elektronegatif ini mendapat caj negatif separa, sedangkan atom lain mendapat caj positif separa. Kemudian ikatan menjadi ikatan kovalen kutub. Apabila molekul ini memenuhi molekul lain yang mempunyai momen dipol seperti ini, caj negatif dan positif cenderung menarik antara satu sama lain. Daya tarikan ini dipanggil ikatan hidrogen.
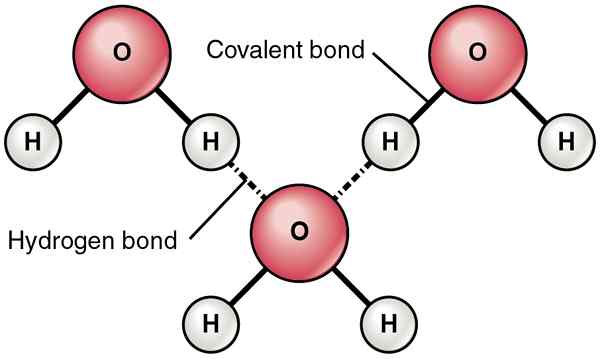
Selain itu, ikatan hidrogen terbentuk antara atom elektronegatif yang sangat tinggi dan kurang atom elektronegatif. Selanjutnya, mereka wujud apabila kita mempunyai O, N, dan F dalam satu molekul dan positif H dalam molekul lain. Ini kerana f, n, dan o adalah atom elektronegatif yang paling mampu membentuk ikatan hidrogen.
Apakah perbezaan antara interaksi dipole dipole dan ikatan hidrogen?
Perbezaan utama antara interaksi dipole dipole dan ikatan hidrogen ialah interaksi dipole dipole berlaku apabila molekul yang dikenakan secara negatif berinteraksi dengan molekul jiran dengan caj positif, sedangkan ikatan hidrogen adalah jenis ikatan dipole-dipole yang kuat yang berlaku di antara o, , Atom F, dan H.
Infographic di bawah membentangkan perbezaan antara interaksi dipole dipole dan ikatan hidrogen dalam bentuk tabular untuk perbandingan bersebelahan.
Ringkasan -Interaksi dipole dipole vs ikatan hidrogen
Interaksi dipole-dipole adalah daya intermolecular yang berlaku di antara molekul polar, manakala ikatan hidrogen adalah sejenis daya tarikan antara dua atom dua molekul yang berbeza. Perbezaan utama antara interaksi dipole dipole dan ikatan hidrogen adalah bahawa interaksi dipole dipole berlaku apabila molekul yang dikenakan secara negatif berinteraksi dengan molekul jiran dengan caj positif, sedangkan ikatan hidrogen adalah jenis ikatan dipole dipole yang kuat yang berlaku di antara o, n, dan atom F dan H.
Rujukan:
1. "Ikatan hidrogen." Kimia Libreetexts, Libetexts, 11 Sept. 2022.
Ihsan gambar:
1. "Interaksi Dipole" oleh Adam Rędzikowski - Fail: Dipole_Interactions.PNG (CC BY-SA 3.0) melalui Commons Wikimedia
2. "210 ikatan hidrogen antara molekul air -01" oleh OpenStax College - Anatomi & Fisiologi, laman web Connexions. 19 Jun 2013. (CC oleh 3.0) melalui Commons Wikimedia


