Apakah perbezaan antara asid sianurik dan asid muriatic
The Perbezaan utama antara asid sianurik dan asid muriatic adalah bahawa asid sianurik berguna dalam menstabilkan klorin dan tidak dapat mengubah pH ke tahap yang jauh lebih rendah, sedangkan asid muriatic berguna dalam menurunkan kealkalian dan pH sistem.
Asid sianurik adalah sebatian berasid yang mempunyai formula kimia (CNOH) 3. Asid muriatik, yang biasanya dikenali sebagai asid hidroklorik, adalah larutan akueus hidrogen klorida.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah asid sianurik
3. Apa itu asid muriatic
4. Asid Cyanuric Vs Asid Muriatic dalam Bentuk Tabular
5. Ringkasan - Asid Cyanuric vs Asid Muriatic
Apakah asid sianurik?
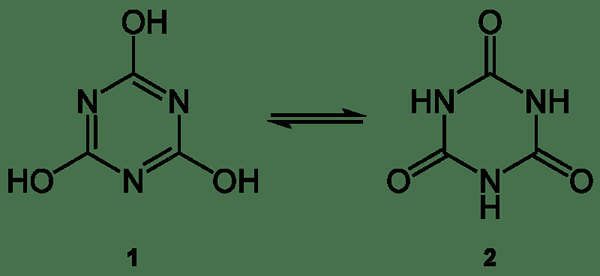
Asid sianurik adalah sebatian berasid yang mempunyai formula kimia (CNOH) 3. Nama kimia sebatian ini ialah 1,3,5-triazine-2,4,6-triol. Sama dengan banyak bahan kimia yang berguna secara industri, triazin ini juga mempunyai banyak sinonim, seperti tricarbimide dan asid isocyanuric.

Rajah 01: Asid Cyanuric
Bahan ini berlaku sebagai pepejal putih, tidak berbau yang berguna sebagai pendahulu untuk peluntur, kuman, dan herba. Asid sianurik boleh didapati sebagai trimer kitaran asid sianik, HOCN. Ia mempunyai struktur cincin yang dapat dengan mudah berinteraksi antara dua struktur isomerinya: keto-enol tautomerism. Tautomer triol mempunyai watak aromatik, tetapi bentuk keto mendominasi dalam penyelesaian. Selain itu, ia mempunyai kumpulan hidroksil yang mempunyai watak fenolik.
Sintesis pertama asid sianurik dilakukan oleh Friedrich Wohler pada tahun 1829. Dia menggunakan penguraian haba urea dan asid urik. Pada zaman moden, kita menggunakan penguraian haba urea, yang mengeluarkan ammonia. Penukaran ini dilakukan pada atau sekitar 175 darjah Celsius.
Apa itu asid muriatic?
Asid muriatik, yang biasanya dikenali sebagai asid hidroklorik, adalah larutan akueus hidrogen klorida. Ia adalah asid yang kuat. Formula kimianya adalah HCl, dan jisim molarnya adalah 36.5 g/mol. Asid ini mempunyai bau pedas. Tambahan pula, penting sebagai sebatian permulaan dalam banyak bahan kimia bukan organik seperti vinil klorida.
Kita boleh mempertimbangkan asid muriatic sebagai bahan yang sangat berasid kerana ia dapat memisahkan sepenuhnya ionnya (ion hidrogen dan ion klorida), dan ia berlaku sebagai sistem asid yang mengandungi klorin yang mudah dalam larutan akueus. Tambahan pula, asid kuat ini dapat menyerang kulit kita ke atas pelbagai komposisi dan boleh menyebabkan luka kulit.

Rajah 02: sebotol asid hidroklorik
Bahan berasid ini secara semula jadi hadir dalam asid gastrik dalam sistem pencernaan kebanyakan haiwan, termasuk manusia. Selain itu, ia boleh didapati secara komersil sebagai bahan kimia perindustrian untuk pengeluaran polyvinyl chloride untuk plastik. Di samping itu, asid HCl berguna sebagai agen penurunan dalam keperluan isi rumah, sebagai bahan tambahan makanan dalam industri makanan, dalam pemprosesan kulit, dan lain -lain.
Asid muriatic berlaku kerana garam ion hidronium dan klorida. Kita boleh mempersiapkannya dengan merawat HCL dengan air. Asid HCl biasanya digunakan dalam analisis kimia untuk penyediaan atau pencernaan sampel untuk analisis. Ini kerana asid HCl pekat boleh membubarkan banyak logam, dan ia boleh membentuk klorida logam teroksida dengan gas hidrogen.
Apakah perbezaan antara asid sianurik dan asid muriatic?
Asid sianurik adalah sebatian berasid yang mempunyai formula kimia (CNOH) 3. Muriatic adalah penyelesaian berair hidrogen klorida. Perbezaan utama antara asid sianurik dan asid muriatic ialah asid sianurik berguna dalam menstabilkan klorin, dan ia tidak dapat mengubah pH ke tahap yang jauh lebih rendah, sedangkan asid muriatic berguna dalam menurunkan kealkalian dan pH sistem.
Infographic di bawah membentangkan perbezaan antara asid sianurik dan asid muriatic dalam bentuk tabular untuk perbandingan sampingan.
Ringkasan -Asid Cyanuric vs Asid Muriatic
Asid sianurik dan asid muriatic adalah asid penting dalam industri. Perbezaan utama antara asid sianurik dan asid muriatic ialah asid sianurik berguna dalam menstabilkan klorin, dan ia tidak dapat mengubah pH ke tahap yang lebih rendah, sedangkan asid muriatic berguna dalam menurunkan kealkalian dan pH sistem.
Rujukan:
1. "Asid HCl (asid hidroklorik) - Struktur, jisim molekul, sifat & kegunaan." Byjus.
Ihsan gambar:
1. "Asid Cyanuric" oleh Yikrazuul - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Asid Hydrochloric 02" oleh Bartłomiej Bulicz - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


