Apakah perbezaan antara model Bohr dan Schrodinger
The Perbezaan utama antara model Bohr dan Schrodinger adalah bahawa dalam model Bohr, elektron adalah zarah yang hanya menduduki orbit tertentu tenaga tetap di sekitar nukleus, sedangkan, dalam model schrodinger, elektron berkelakuan sebagai gelombang berdiri yang mempunyai kebarangkalian yang lebih besar berada di beberapa kawasan berbanding dengan yang lain.
Model Model dan Schrodinger Bohr adalah model yang sangat penting dalam kimia kerana mereka menggambarkan struktur kimia atom dan lokasi elektron pada masa tertentu.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu model bohr
3. Apakah model Schrodinger
4. Model bohr vs schrodinger dalam bentuk jadual
5. Ringkasan -Model Bohr vs Schrodinger
Apa itu model bohr?
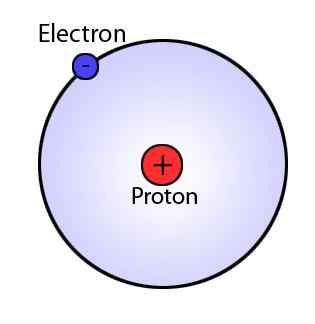
Model Bohr, yang merupakan pengubahsuaian model Rutherford, menerangkan struktur atom seperti yang terdiri daripada nukleus yang dikelilingi oleh elektron. Walau bagaimanapun, model Bohr sangat maju daripada model Rutherford kerana ia menunjukkan bahawa elektron sentiasa bergerak dalam cengkerang tertentu atau orbit di sekitar nukleus. Model ini juga menyatakan bahawa cengkerang ini mempunyai tenaga yang berbeza dan bentuk sfera. Fenomena ini dicadangkan oleh pemerhatian spektrum garis untuk atom hidrogen.
Oleh kerana terdapat garis diskret dalam spektrum garis, Bohr menyatakan bahawa orbital atom mempunyai tenaga tetap, dan elektron dapat melompat dari satu tahap tenaga ke tenaga yang lain memancarkan atau menyerap tenaga, mengakibatkan garis dalam spektrum garis.

Rajah 01: Model Bohr
Postulates utama model Bohr
- Elektron bergerak di sekitar nukleus dalam orbital sfera, yang mempunyai saiz dan tenaga tetap.
- Setiap orbit mempunyai jejari yang berbeza dan dinamakan dari nukleus ke luar sebagai n = 1, 2, 3, dll., atau n = k, l, m, dll., di mana n ialah nombor tahap tenaga tetap.
- Tenaga orbital berkaitan dengan saiznya.
- Orbit terkecil mempunyai tenaga terendah. Atom sepenuhnya stabil apabila elektron berada di tahap tenaga terendah.
- Apabila elektron bergerak di orbital tertentu, tenaga elektron itu tetap.
- Elektron boleh bergerak dari satu tahap tenaga ke yang lain dengan menyerap atau melepaskan tenaga.
- Pergerakan ini menyebabkan sinaran.
Umumnya, model Bohr sesuai dengan atom hidrogen, yang mempunyai satu elektron dan nukleus yang kecil. Selain itu, Bohr menggunakan pemalar papan untuk mengira tenaga tahap tenaga atom.
Tetapi terdapat beberapa kelemahan model Bohr ketika menjelaskan struktur atom atom selain hidrogen.
Batasan model Bohr
- Model Bohr tidak dapat menjelaskan kesan zeeman (kesan medan magnet pada spektrum atom).
- Ia tidak dapat menjelaskan kesan tegak (kesan medan elektrik pada spektrum atom).
- Model Bohr gagal menerangkan spektrum atom atom yang lebih besar.
Apakah model Schrodinger?
Model Schrodinger adalah model dalam kimia yang mengandaikan bahawa elektron adalah gelombang. Model ini menerangkan kawasan di ruang angkasa atau orbital sebagai lokasi di mana elektron kemungkinan besar berlaku. Ini adalah model atom yang kuat yang dibangunkan oleh Erwin Schrodinger pada tahun 1926. Dia menggabungkan persamaan untuk tingkah laku gelombang dan persamaan de broglie untuk mewujudkan model matematik untuk menggambarkan pengedaran elektron dalam atom.

Rajah 02: Fungsi gelombang seperti yang diterangkan oleh schrodinger
Kelebihan utama model Schrodinger ialah ia mengandungi persamaan matematik yang dikenali sebagai fungsi gelombang, yang dapat memenuhi keperluan tempat -tempat pada tingkah laku elektron. Walau bagaimanapun, sukar untuk membayangkan model fizikal untuk elektron sebagai gelombang. Daripada cuba memberitahu di mana elektron pada bila -bila masa, model ini menerangkan kebarangkalian elektron yang terdapat di kawasan ruang tertentu pada masa tertentu.
Apakah perbezaan antara model Bohr dan Schrodinger?
Model Bohr dan Schrodinger adalah seperti asas -asas kimia umum. Perbezaan utama antara model Bohr dan Schrodinger ialah dalam model Bohr, elektron adalah zarah yang hanya menduduki orbit tertentu tenaga tetap di sekitar nukleus, sedangkan, dalam model Schrodinger, elektron berkelakuan sebagai gelombang berdiri yang mempunyai kebarangkalian yang lebih besar dalam beberapa kawasan ruang berbanding dengan yang lain.
Berikut adalah ringkasan perbezaan antara model Bohr dan Schrodinger dalam bentuk tabular untuk perbandingan sampingan.
Ringkasan -Model Bohr vs Schrodinger
Kedua -dua model Bohr dan model Schrodinger menggambarkan struktur kimia atom dan lokasi elektron pada masa tertentu. Perbezaan utama antara model Bohr dan Schrodinger ialah dalam model Bohr, elektron adalah zarah yang hanya menduduki orbit tertentu tenaga tetap di sekitar nukleus, sedangkan, dalam model Schrodinger, elektron berkelakuan sebagai gelombang berdiri yang mempunyai kebarangkalian yang lebih besar dalam beberapa kawasan ruang berbanding dengan yang lain.
Rujukan:
1. "Model Schrodinger." Erwin Schrödinger, Pendidikan Purdue.
Ihsan gambar:
1. "Model Bohr" oleh Jia.Liu - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "WavePacket-A2K4-EN" oleh Xcodexif-Kerja Sendiri (CC BY-SA 4.0) melalui Commons Wikimedia


