Perbezaan antara trypsin dan chymotrypsin
Perbezaan utama - trypsin vs chymotrypsin
Pencernaan protein adalah proses yang sangat penting dalam prosedur pencernaan keseluruhan dalam organisma hidup. Protein kompleks dicerna ke dalam monomer asid amino dan diserap melalui usus kecil. Protein adalah penting kerana mereka berfungsi sebagai fungsi utama dan peranan struktur dalam organisma. Pencernaan protein berlaku melalui enzim pencernaan protein yang termasuk trypsin, chymotrypsin, peptidases, dan protease. Trypsin adalah enzim pencabutan protein yang memecah ikatan peptida pada asid amino asas yang termasuk lisin dan arginin. Chymotrypsin juga merupakan enzim yang mencerna protein yang memecahkan ikatan peptida pada asid amino aromatik seperti phenylalanine, tryptophan, dan tirosin. The Perbezaan utama Antara trypsin dan chymotrypsin adalah kedudukan asid amino di mana ia berpakaian dalam protein. Trypsin cleaves pada kedudukan asid amino asas manakala chymotrypsin cleaves pada kedudukan asid amino aromatik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu trypsin
3. Apa itu Chymotrypsin
4. Persamaan antara trypsin dan chymotrypsin
5. Perbandingan sampingan - trypsin vs chymotrypsin dalam bentuk jadual
6. Ringkasan
Apa itu trypsin?
Trypsin adalah 23.3 kDa protein yang dimiliki oleh keluarga serine protease dan substrat utamanya adalah asid amino asas. Asid amino asas ini termasuk arginine dan lisin. Trypsin ditemui pada tahun 1876 oleh Kuhne. Trypsin adalah protein globular dan wujud dalam bentuk tidak aktif yang trypsinogen - zymogen. Mekanisme tindakan trypsin berdasarkan aktiviti protease serine.
Trypsin berpakaian di hujung terminal C asid amino asas. Ini adalah tindak balas hidrolisis dan berlaku pada pH - 8.0 di usus kecil. Pengaktifan trypsinogen berlaku melalui penyingkiran hexapeptide terminal, dan ia menghasilkan bentuk aktif; trypsin. Trypsin aktif adalah dua jenis utama; α - trypsin dan β -trypsin. Mereka berbeza dalam kestabilan terma dan struktur mereka. Tapak aktif trypsin mengandungi histidine (H63), asid aspartik (D107) dan serine (S200).
Rajah 01: trypsin
Tindakan enzimatik trypsin dihalang oleh DFP, aprotinin, AG+, Benzamidine, dan EDTA. Aplikasi trypsin termasuk pemisahan tisu, trypsinization dalam budaya sel haiwan, pemetaan tryptic, in vitro Kajian protein, cap jari dan aplikasi budaya tisu.
Apa itu Chymotrypsin?
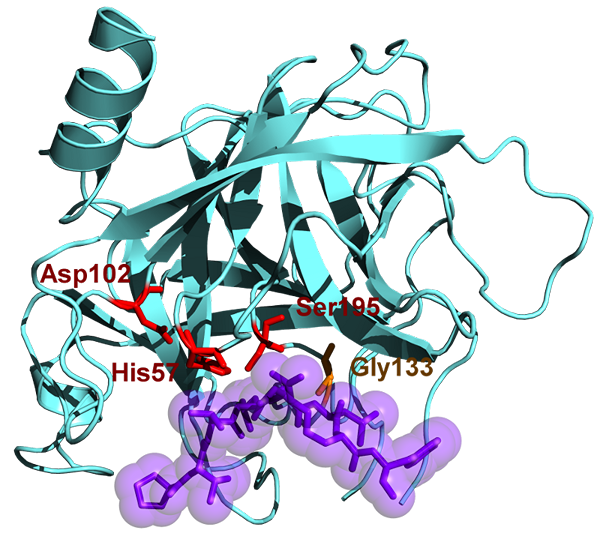
Chymotrypsin mempunyai berat molekul 25.6 kDa dan milik keluarga Serine Protease, dan ia adalah endopeptidase. Chymotrypsin wujud dalam bentuk yang tidak aktifnya iaitu chymotrypsinogen. Chymotrypsin ditemui pada tahun 1900 -an. Chymotrypsin menghidrolisis ikatan peptida pada asid amino aromatik. Substrat aromatik ini termasuk tirosin, phenylalanine, dan tryptophan. Substrat enzim ini terutamanya dalam l-isomer dan mudah bertindak atas amida dan ester asid amino. PH optimum di mana tindakan chymotrypsin adalah 7.8 - 8.0. Terdapat dua bentuk utama chymotrypsin seperti chymotrypsin A dan chymotrypsin B dan mereka sedikit berbeza di sana ciri -ciri struktur dan proteolitik. Tapak aktif chymotrypsin mengandungi triad pemangkin dan terdiri daripada histidin (H57), asid aspartik (D102) dan serine (S195).

Rajah 02: Chymotrypsin
Pengaktifan chymotrypsin adalah cetyltrimethylammonium bromida, dodecyltrimethylammonium bromida, hexadecyltrimethylammonium bromida dan tetrabutylammonium bromida. Inhibitor chymotrypsin adalah peptidil aldehid, asid boronik, dan derivatif coumarin. Chymotrypsin digunakan secara komersil dalam sintesis peptida, pemetaan peptida dan cap jari peptida.
Apakah persamaan antara trypsin dan chymotrypsin?
- Kedua -dua enzim adalah protease serine.
- Kedua -dua enzim mengikat ikatan peptida.
- Kedua -dua enzim bertindak dalam usus kecil.
- Kedua -dua enzim wujud dalam bentuk yang tidak aktif sebagai zymogens.
- Kedua -dua enzim terdiri daripada triad pemangkin yang mengandungi histidin, asid aspartik, dan serine di tapak aktifnya.
- Kedua -dua enzim pada mulanya ditemui dan diekstrak dari lembu.
- Pengeluaran kedua -dua enzim dilakukan melalui teknik DNA rekombinan pada masa ini.
- Kedua -dua enzim bertindak pada pH asas yang optimum.
- Kedua -dua enzim digunakan in vitro dalam industri yang berbeza.
Apakah perbezaan antara trypsin dan chymotrypsin?
Trypsin vs Chymotrypsin | |
| Trypsin adalah enzim pencabutan protein yang akan memecah ikatan peptida pada asid amino asas seperti lisin dan arginin. | Chymotrypsin yang juga merupakan enzim yang mencerna protein memecah ikatan peptida pada asid amino aromatik seperti phenylalanine, tryptophan, dan tirosin. |
| Berat molekul | |
| Berat molekul trypsin adalah 23.3 k da. | Berat molekul chymotrypsin adalah 25.6 k da. |
| Substrat | |
| Protein kompleks dicerna ke dalam monomer asid amino dan diserap melalui usus kecil. | Substrat asid amino aromatik seperti tirosin, tryptophan, dan phenylalanine bertindak pada chymotrypsin. |
| Bentuk enzim zymogen | |
| Trypsinogen adalah bentuk trypsin yang tidak aktif. | Chymotrypsinogen adalah bentuk chymotrypsin yang tidak aktif. |
| Pengaktif | |
| Lanthanides adalah pengaktif trypsin. | Cetyltrimethylammonium bromida, dodecyltrimethylammonium bromida, hexadecyltrimethylammonium bromida dan tetrabutylammonium bromida adalah pengaktifan chymotrypsin. |
| Perencat | |
| DFP, Aprotinin, AG+, Benzamidine, dan EDTA adalah inhibitor trypsin. | Peptidil aldehid, asid boronik, dan derivatif coumarin adalah inhibitor chymotrypsin. |
Ringkasan -trypsin vs chymotrypsin
Peptidase atau enzim proteolitik mengepam protein melalui hidrolisis ikatan peptida. Trypsin memadamkan ikatan peptida pada asid amino asas manakala chymotrypsin memadamkan ikatan peptida pada residu asid amino aromatik. Kedua -dua enzim adalah peptidase serine dan bertindak dalam usus kecil dalam persekitaran pH asas. Pada masa ini, banyak penyelidikan terlibat dalam menghasilkan trypsin dan chymotrypsin menggunakan teknologi DNA rekombinan dengan menggunakan spesies bakteria dan kulat yang berbeza kerana enzim ini mempunyai nilai perindustrian yang tinggi. Ini adalah perbezaan antara trypsin dan chymotrypsin.
Muat turun versi pdf trypsin vs chymotrypsin
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi pdf di sini perbezaan antara trypsin dan chymotrypsin
Rujukan:
1."Chymotrypsin."Chymotrypsin - Manual Enzim Worthington. Terdapat di sini
2."Trypsin."Trypsin - Manual Enzim Worthington. Terdapat di sini
Ihsan gambar:
1.'Serine Protease'by Tinastella di Wikibooks Bahasa Inggeris (Domain Awam) melalui Commons Wikimedia
2.'Chymotrypsin 4cha'by yikrazuul - kerja sendiri, (cc by -sa 3.0) melalui Commons Wikimedia


