Perbezaan antara tonik dan osmolariti
The Perbezaan utama antara tonik dan osmolariti adalah bahawa Tonicity mengukur hanya kepekatan larutan yang tidak menembusi melalui membran semipermeable sementara Osmolarity mengukur jumlah kepekatan larutan menembusi dan tidak menembusi.
Osmolarity adalah ukuran tekanan osmotik penyelesaian. Dalam istilah yang lebih mudah, ia adalah kira -kira ukuran jumlah larutan dalam penyelesaian. Sebaliknya, tonik merujuk kepada kepekatan relatif zarah larut di dalam sel berkenaan dengan kepekatan di luar sel. Oleh itu, kedua -dua tonik dan osmolariti nampaknya konsep serupa. Walau bagaimanapun, terdapat perbezaan yang akan kita bincangkan dalam artikel ini.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu tonik
3. Apakah osmolarity
4. Perbandingan sampingan - Tonicity vs Osmolarity dalam bentuk jadual
5. Ringkasan
Apa itu tonik?
Tonicity adalah ukuran kecerunan tekanan osmotik dengan potensi air dua penyelesaian yang dipisahkan oleh membran semipermeable. Ia bermaksud; Tonicity istilah menerangkan kepekatan relatif larutan larutan i yang menentukan arah dan tahap penyebaran. Pengukuran ini penting dalam menentukan tindak balas sel yang direndam dalam penyelesaian luaran.

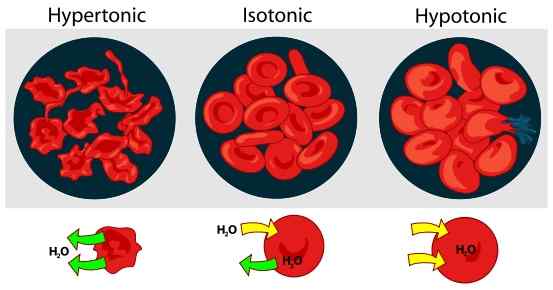
Rajah 01: Kesan tonik pada sel darah merah dalam larutan luaran
Tidak seperti tekanan osmotik, tonik hanya dipengaruhi oleh larutan yang tidak dapat melalui membran. Larutan yang boleh melalui membran secara bebas tidak mempunyai pengaruh pada tonik. Ini kerana, kepekatan larutan ini akan sentiasa sama di kedua -dua belah membran. Biasanya, kami menyatakan tonik berkenaan dengan penyelesaian lain. Oleh itu, terdapat tiga jenis penyelesaian berdasarkan tonik; penyelesaian hipertonik, penyelesaian hipotonik, dan penyelesaian isotonik. Penyelesaian hipertonik mempunyai kepekatan larut yang tinggi daripada penyelesaian lain sementara larutan hipotonik mempunyai kepekatan larut yang lebih rendah. Penyelesaian menjadi isotonik jika kepekatan osmole yang berkesan penyelesaiannya adalah sama dengan penyelesaian lain.
Apakah osmolarity?
Kepekatan osmolariti atau osmotik adalah ukuran kepekatan larut yang diberikan oleh unit osmoles larut seliter penyelesaian. Kita boleh menandakan unit sebagai OSM/L. Begitu juga, kita boleh menggunakan nilai ini untuk mengukur tekanan osmotik penyelesaian. Oleh itu, tonik penyelesaian juga. Persamaan yang boleh kita gunakan untuk mengukur parameter ini adalah seperti berikut:
Osmolarity = ΣψiniCi
Di sini, ψ adalah pekali osmotik, n adalah bilangan zarah yang mana molekul memisahkan, dan c adalah kepekatan molar larut. Begitu juga, terdapat tiga jenis penyelesaian mengikut osmolarity; isosmotik, hiperosmotik dan hypoosmotic.
Apakah perbezaan antara tonik dan osmolariti?
Istilah Tonicity dan Osmolarity berkaitan tetapi konsep yang berbeza. Sebab mengapa mereka berkaitan dengan satu sama lain adalah bahawa kedua -dua istilah ini membandingkan kepekatan larut dua penyelesaian yang dipisahkan dari membran semipermeable. Terma ini berbeza antara satu sama lain mengikut jenis larutan yang mereka ambil kira semasa mengukur. Oleh itu, perbezaan utama antara tonik dan osmolariti adalah bahawa tonicity mengukur hanya kepekatan larutan yang tidak menembusi melalui membran semipermeable manakala osmolarity mengukur jumlah kepekatan penembusan dan tidak menembusi larutan.
Infographic di bawah memberikan fakta lanjut mengenai perbezaan antara tonik dan osmolariti.

Ringkasan -Tonicity vs Osmolarity
Istilah osmolariti dan tonik adalah antara yang berkaitan kerana kedua-dua istilah ini membandingkan kepekatan larut dalam penyelesaian. Tetapi, pada masa yang sama, istilahnya adalah konsep kimia yang berbeza mengikut jenis larutan yang mereka ambil kira dalam pengukuran mereka. Oleh itu, perbezaan utama antara tonik dan osmolariti adalah bahawa tonik hanya mengukur kepekatan larutan yang tidak menembusi melalui membran semipermeable manakala osmolarity mengukur jumlah kepekatan penembusan dan tidak menembusi larutan larutan.
Rujukan:
1. "Tonicity."Wikipedia, Yayasan Wikimedia, 8 Feb. 2018. Terdapat di sini
2. "Kepekatan osmotik."Wikipedia, Yayasan Wikimedia, 15 Okt. 2018. Terdapat di sini
Ihsan gambar:
1."Tekanan Osmotik pada Rajah Sel Darah" oleh Ladyofhats - Kerja Sendiri (Domain Awam) melalui Wikimedia Commons


