Perbezaan antara titrasi dan peneutralan

The Perbezaan utama antara titrasi dan peneutralan ialah Titrasi adalah teknik analisis, sedangkan peneutralan adalah tindak balas kimia.
Titrasi dan peneutralan adalah istilah yang sangat penting dalam kimia. Titrasi adalah teknik yang memerlukan radas tertentu, dan ia diteruskan berdasarkan reaksi peneutralan. Reaksi peneutralan adalah tindak balas kimia di mana keasidan seimbang dengan penambahan asas atau sebaliknya untuk mendapatkan penyelesaian neutral.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu titrasi
3. Apa itu peneutralan
4. Perbandingan sampingan -titrasi vs peneutralan dalam bentuk jadual
5. Ringkasan
Apa itu titrasi?
Titrasi adalah teknik analisis yang berguna dalam mengukur kepekatan penyelesaian kimia tertentu. Kita boleh melakukan ini menggunakan penyelesaian yang mempunyai kepekatan yang diketahui. Proses titrasi memerlukan alat tertentu.
Dalam alat titrasi, terdapat buret yang biasanya mengandungi penyelesaian standard dengan kepekatan yang diketahui. Sekiranya penyelesaian dalam burette bukan penyelesaian standard, ia harus diseragamkan menggunakan standard utama. Kotak titrasi dipenuhi dengan sampel yang diperbuat daripada komponen kimia dengan kepekatan yang tidak diketahui. Sekiranya penyelesaian standard (dalam burette) tidak dapat bertindak sebagai penunjuk diri, kita harus menambah penunjuk yang sesuai untuk sampel dalam kelalang titrasi.
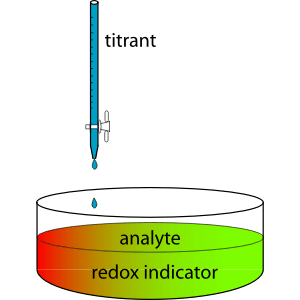
Rajah 01: Reaksi titrasi
Semasa proses titrasi, penyelesaian piawai ditambah ke dalam kelalang perlahan sehingga perubahan warna berlaku. Perubahan warna penyelesaian analit menunjukkan titik akhir titrasi. Walaupun ia bukan titik tepat di mana titrasi berakhir, kita boleh mengandaikan bahawa ia adalah titik kesetaraan kerana hanya terdapat sedikit perbezaan (titik kesetaraan adalah titik di mana reaksi sebenarnya berhenti).
Bacaan burette berguna untuk menentukan jumlah penyelesaian standard yang bertindak balas dengan sampel. Kemudian dengan menggunakan tindak balas kimia dan hubungan stoikiometri, kita dapat mengira kepekatan yang tidak diketahui.
Apa itu peneutralan?
Istilah peneutralan merujuk kepada tindak balas kimia antara asid dan asas, yang menghasilkan penyelesaian neutral. PH penyelesaian neutral ialah pH = 7. Reaksi peneutralan melibatkan gabungan h+ ion dan oh- ion untuk membentuk molekul air.

Rajah 02: Peneutralan natrium hidroksida dan asid hidroklorik
Jika pH akhir campuran asid dan reaksi asas ialah 7, ini bermakna jumlah h yang sama+ Dan oh- ion telah bertindak balas dalam tindak balas ini (untuk membentuk molekul air satu h+ ion bertindak balas dengan satu oh- ion). Asid dan asas yang bertindak balas boleh menjadi kuat atau lemah. Bergantung pada sifat asid dan asas, terdapat beberapa jenis tindak balas peneutralan seperti berikut:
- Tindak balas asas asid kuat yang kuat
- Reaksi asas asid-weak yang kuat
- Reaksi asas asid-weak lemah
- Reaksi asas asid yang lemah
Di antara empat jenis ini, hanya tindak balas antara asid kuat dan pangkalan yang kuat memberikan penyelesaian yang dinetralkan yang mempunyai pH = 7. Reaksi lain memberikan penyelesaian yang dinetralkan dengan nilai pH yang berbeza -beza disebabkan oleh variasi pH asid/asas.
Apakah perbezaan antara titrasi dan peneutralan?
Titrasi dan peneutralan adalah istilah yang sangat penting dalam kimia. Titrasi adalah teknik yang memerlukan radas tertentu, dan ia diteruskan berdasarkan reaksi peneutralan. Perbezaan utama antara titrasi dan peneutralan ialah titrasi adalah teknik analisis, sedangkan peneutralan adalah reaksi kimia.
Di bawah infographic membandingkan perbezaan antara titrasi dan peneutralan dalam bentuk jadual.
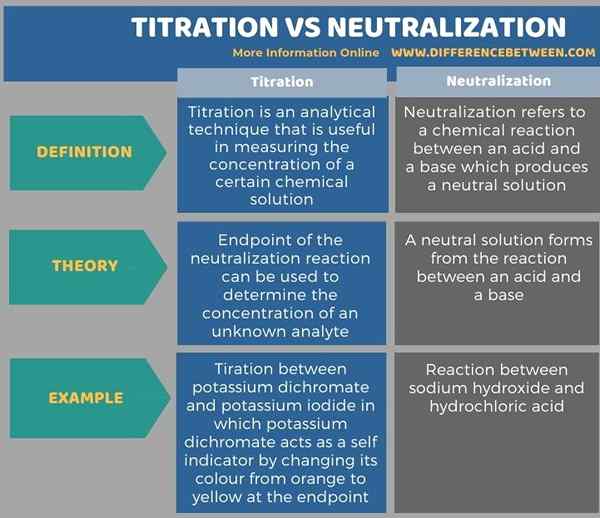
Ringkasan -titrasi vs peneutralan
Titrasi dan peneutralan adalah istilah yang sangat penting dalam kimia. Titrasi adalah teknik yang memerlukan radas tertentu, dan ia diteruskan berdasarkan reaksi peneutralan. Perbezaan utama antara titrasi dan peneutralan ialah titrasi adalah teknik analisis, sedangkan peneutralan adalah reaksi kimia.
Rujukan:
1. "Titrasi."Kimia Libretexts, Libretexts, 23 Jun 2019, boleh didapati di sini.
Ihsan gambar:
1. "Titrasi Redoks Menggunakan Penunjuk" (CC0) melalui SVG Percuma
2. "Reaksi peneutralan antara natrium hidroksida dan asid hidroklorik" oleh bluescan sv.Wiki - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


