Perbezaan antara titanium oksida dan titanium dioksida

The Perbezaan utama antara titanium oksida dan titanium dioksida ialah Titanium oksida mengandungi satu anion oksigen setiap satu kation titanium manakala titanium dioksida mengandungi dua anion oksigen setiap satu kation titanium.
Titanium adalah elemen kimia yang mempunyai simbol kimia ti dan nombor atom 22. Ia adalah logam berkilau yang berada di bawah kategori logam peralihan. Sebagai ciri utama, ia mempunyai kekuatan yang tinggi berbanding dengan ketumpatannya yang rendah. Unsur ini boleh mempunyai beberapa keadaan pengoksidaan, tetapi keadaan pengoksidaan yang paling stabil ialah +4. Terdapat beberapa oksida yang boleh dibentuk seperti titanium (II) oksida, titanium (III) oksida dan titanium dioksida.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Titanium Oxide
3. Apa itu titanium dioksida
4. Perbandingan sampingan - titanium oksida vs titanium dioksida dalam bentuk jadual
5. Ringkasan
Apa itu Titanium Oxide?
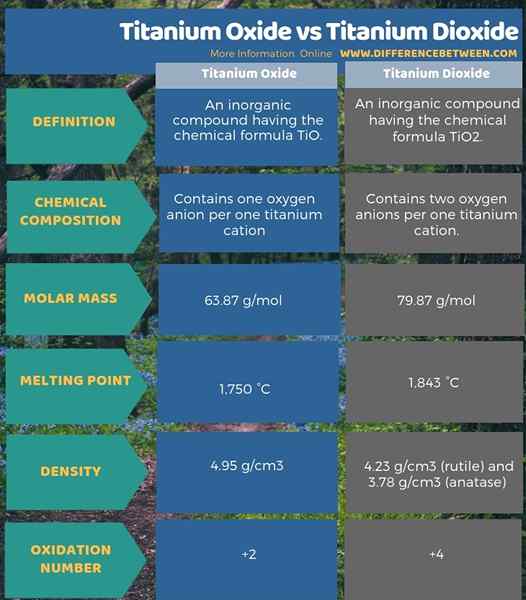
Titanium Oxide adalah sebatian bukan organik yang mempunyai formula kimia TiO. Kami namakan sebatian ini sebagai titanium monoksida atau titanium (ii) oksida. Jisim molar sebatian ini ialah 63.87 g/mol. Nampaknya sebagai kristal gangsa. Selain itu, ia mempunyai titik lebur yang tinggi iaitu 1,750 ° C, dan ketumpatannya adalah 4.95 g/cm3. Apabila mempertimbangkan struktur kristal sebatian ini, ia mempunyai struktur padu.
Kami boleh menyediakan sebatian ini dari titanium dioksida atau dari logam titanium juga. Tetapi kita mesti melakukan reaksi ini pada suhu 1500 ° C. Selain itu, penyelesaian asid kompaun ini stabil untuk masa yang singkat, tetapi kemudian ia akan terurai untuk memberikan hidrogen. Reaksi ini adalah seperti berikut:
2ti2+(aq) + 2h+(aq) → 2ti3+(aq) + h2(g)
Apa itu titanium dioksida?
Titanium dioksida adalah sebatian bukan organik yang mempunyai formula kimia TiO2. Ini adalah oksida titanium yang berlaku secara semula jadi. Selain itu, kami namakan sebatian ini sebagai Titanium (iv) oksida. Jisim molar sebatian ini adalah 79.87 g/mol. Ia kelihatan sebagai pepejal putih. Ia mempunyai titik lebur yang tinggi iaitu 1,843 ° C. Ketumpatan sebatian ini berbeza -beza mengikut jenis struktur kristal di mana ia wujud. Sebagai contoh, ketumpatan struktur kristal rutil ialah 4.23 g/cm3 Walaupun ketumpatan struktur kristal anatase adalah 3.78 g/cm3.

Rajah 01: Pepejal putih titanium dioksida
Kita boleh menghasilkan sebatian ini dari pemprosesan pasir titanium seperti pasir mineral ilmenite. Apabila mempertimbangkan aplikasi utama kompaun ini, ia termasuk pengeluaran pigmen titanium dioksida yang penting untuk pengeluaran cat, kertas, plastik, dan lain -lain.
Apakah perbezaan antara titanium oksida dan titanium dioksida?
Titanium Oxide adalah sebatian bukan organik yang mempunyai formula kimia tio manakala titanium dioksida adalah sebatian bukan organik yang mempunyai formula tio kimia2. Oleh itu, titanium oksida mengandungi satu anion oksigen setiap satu kation titanium tetapi, titanium dioksida mengandungi dua anion oksigen setiap satu kation titanium. Ini adalah perbezaan utama antara titanium oksida dan titanium dioksida. Juga, kerana struktur ini, mereka mempunyai massa molar yang berbeza dan titik lebur yang berbeza juga. Selain itu, bilangan pengoksidaan titanium dalam setiap sebatian adalah berbeza antara satu sama lain; Bilangan pengoksidaan titanium dalam titanium oksida adalah +2 manakala bilangan pengoksidaan titanium dalam titanium dioksida adalah +4. Ini adalah satu lagi perbezaan penting antara titanium oksida dan titanium dioksida.
Infographic di bawah ini membezakan perbezaan antara titanium oksida dan titanium dioksida dengan lebih terperinci.
Ringkasan -Titanium Oxide vs Titanium dioksida
Titanium oksida dan titanium dioksida adalah oksida penting unsur kimia titanium. Perbezaan utama antara titanium oksida dan titanium dioksida ialah titanium oksida mengandungi satu anion oksigen setiap satu kation titanium tetapi, titanium dioksida mengandungi dua anion oksigen setiap satu kation titanium.
Rujukan:
1. "Titanium (ii) oksida."Wikipedia, Yayasan Wikimedia, 19 Ogos. 2018. Terdapat di sini
2. "Titanium dioksida."Wikipedia, Yayasan Wikimedia, 26 Ogos. 2018. Terdapat di sini
Ihsan gambar:
1."Titanium (IV) Oxide" oleh Walkerma di Wikipedia Bahasa Inggeris. (Domain Awam) melalui Wikimedia Commons


