Perbezaan antara THF dan dioksana

The Perbezaan utama antara THF dan dioksana adalah Molekul THF mengandungi satu atom oksigen sebagai ahli struktur cincin manakala molekul dioksana mengandungi dua atom oksigen sebagai anggota struktur cincin.
Kedua -dua THF dan dioksana adalah pelarut organik yang penting dalam menganalisis sampel. Struktur organik ini adalah struktur kitaran yang dapat diklasifikasikan sebagai sebatian heterosiklik kerana struktur cincin ini mengandungi dua jenis atom yang membentuk cincin: atom karbon dan atom oksigen (s).
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu THF
3. Apa itu dioksana
4. Perbandingan sampingan - THF vs dioksana dalam bentuk jadual
5. Ringkasan
Apa itu THF?
THF adalah pelarut organik yang mempunyai formula kimia (CH2) 4O. Ia adalah sebatian heterosiklik, dan kita boleh mengkategorikannya sebagai eter kerana kumpulan fungsi molekul THF adalah -c-o-c-. Kita dapat memerhatikan THF sebagai cecair organik tanpa warna yang boleh didapati dengan air. Pelarut ini mempunyai bau seperti eter. Ia juga mempunyai kelikatan yang rendah. Pelarut ini digunakan terutamanya sebagai pendahulu untuk proses sintesis polimer. THF adalah molekul kutub yang membantu mencampurkannya dengan air. Di samping itu, polariti ini menjadikan pelarut serba boleh.

Rajah 01: Pelarut THF
Apabila mempertimbangkan aplikasi pelarut THF, penting dalam proses pempolimeran; Dengan kehadiran asid kuat, THF menukarkan bahan polimer linear, poli (tetramethylene eter) glikol atau ptmeg. Bahan polimer ini berguna dalam pengeluaran gentian poliuretana elastomerik seperti spandeks.
Tambahan pula, THF adalah penting sebagai pelarut untuk PVC dan dalam varnis. Ini kerana THF adalah pelarut aprotik yang mempunyai pemalar dielektrik 7.6. Kita boleh mengklasifikasikan THF sebagai pelarut polar sederhana yang dapat membubarkan pelbagai sebatian kimia nonpolar dan kutub.
Selain itu, THF berguna sebagai komponen dalam fasa mudah alih untuk kromatografi cecair fasa terbalik. THF digunakan dalam teknik ini kerana ia mempunyai kekuatan elusi yang hebat daripada metanol atau asetonitril, tetapi kurang biasa digunakan daripada pelarut ini.
Apa itu dioksana?
Dioxane adalah sebatian organik heterosiklik yang mempunyai formula kimia C4H8O2. Kita boleh mengklasifikasikannya sebagai eter di mana terdapat dua kumpulan-c-o-c-eter kumpulan. Ia wujud sebagai cecair tanpa warna yang mempunyai bau seperti eter ringan. Terdapat tiga isomer dioksana sebagai 1,2-dioksana, 1,3-dioksan, dan 1,4-dioksana. Antara tiga sebatian ini, 1,4-dioksana adalah sebatian biasa di mana sebatian lain jarang ditemui.
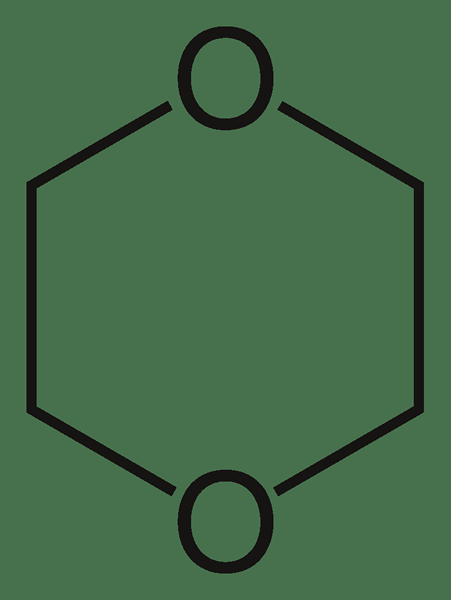
Rajah 02: Struktur molekul dioksana
Apabila mempertimbangkan sintesis, dioksana boleh dihasilkan melalui dehidrasi asid-catalyzed diethylene glycol. Kita boleh mendapatkan diethylene glikol dari hidrolisis etilena oksida. Cecair ini boleh didapati dengan air kerana ia adalah kutub.
Dioxane penting dalam pengangkutan trichloroethane sebagai penstabil. Selain itu, penting sebagai pelarut aprotik untuk dakwat, pelekat, dan ester selulosa. Kita boleh menggunakan pelarut ini sebagai pengganti dari THF dalam beberapa proses kerana ketoksikan yang rendah dan titik mendidih tinggi pelarut dioksana.
Apakah perbezaan antara THF dan dioksana?
Kedua -dua THF dan dioksana adalah pelarut organik yang penting dalam menganalisis sampel. Perbezaan utama antara THF dan dioksana ialah molekul THF mengandungi satu atom oksigen sebagai ahli struktur cincin manakala molekul dioksana mengandungi dua atom oksigen sebagai anggota struktur cincin. Kita boleh menggunakan dioksana sebagai pengganti THF kerana ketoksikan yang rendah dan titik mendidih tinggi.
Di bawah infographic menunjukkan lebih banyak maklumat mengenai perbezaan antara THF dan dioksana.

Ringkasan -thf vs dioxane
Kedua -dua THF dan dioksana adalah pelarut organik yang penting dalam menganalisis sampel. Perbezaan utama antara THF dan dioksana ialah molekul THF mengandungi satu atom oksigen sebagai ahli struktur cincin manakala molekul dioksana mengandungi dua atom oksigen sebagai anggota struktur cincin.
Rujukan:
1. "1,4-dioksana."Wikipedia, Yayasan Wikimedia, 9 Sept. 2020, boleh didapati di sini.
Ihsan gambar:
1. "Tetrahydrofuran Contoh" oleh LHCHEM - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
2. "1-4-dioksan" oleh Rhododendronbusch-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


