Perbezaan antara tindak balas sintesis dan tindak balas penggantian
The Perbezaan utama antara tindak balas sintesis dan tindak balas penggantian ialah Reaksi sintesis memberikan sebatian kimia baru yang terbentuk daripada gabungan reaktan, sedangkan tindak balas penggantian memberikan sebatian kimia yang diperolehi dari sebatian kimia yang ada.
Tindak balas sintesis dan tindak balas penggantian adalah tindak balas sintesis organik yang penting. Kedua -dua tindak balas ini membentuk sebatian kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah reaksi sintesis
3. Apakah reaksi penggantian
4. Perbandingan sampingan - tindak balas sintesis vs tindak balas penggantian dalam bentuk jadual
5. Ringkasan
Apakah reaksi sintesis?
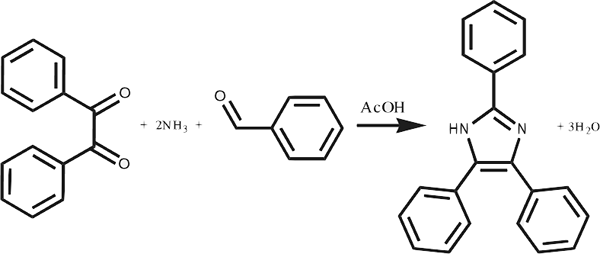
Reaksi sintesis adalah jenis tindak balas kimia di mana dua atau lebih komponen menggabungkan antara satu sama lain untuk membentuk sebatian besar. Reaksi sintesis adalah bertentangan dengan tindak balas pemisahan. Kita boleh menyebutnya tindak balas gabungan langsung juga kerana ia melibatkan gabungan komponen untuk membentuk sebatian baru. Tambahan pula, reaktan dalam tindak balas ini sama ada unsur kimia atau molekul. Produk akhir tindak balas sintesis selalu menjadi sebatian atau kompleks.
Sebagai contoh, gabungan gas hidrogen dan gas oksigen yang membentuk molekul air, gabungan karbon monoksida dan oksigen yang membentuk karbon dioksida, gabungan gas aluminium dan gas oksigen yang membentuk aluminium oksida, dan lain -lain.

Rajah 01: Pembentukan sebatian kimia besar melalui gabungan molekul reaktan kecil
Kita dapat mengenali tindak balas sintesis melalui mengamati produk akhir; ia selalu menjadi kompaun. Dalam tindak balas ini, semua atom yang terdapat dalam molekul reaktan perlu hadir dalam produk akhir. Selain itu, semasa pembentukan bon, tindak balas ini melepaskan tenaga; Oleh itu, mereka adalah reaksi eksotermik.
Apakah reaksi penggantian?
Reaksi penggantian adalah tindak balas kimia di mana molekul molekul menggantikan molekul molekul lain. Moiety adalah sebahagian daripada molekul. Dalam tindak balas ini, moieties adalah sama ada atom, ion, atau kumpulan berfungsi. Selanjutnya, tindak balas ini kebanyakannya berlaku dengan menggantikan kumpulan fungsi molekul dengan kumpulan fungsi lain. Reaksi kimia ini adalah tindak balas yang sangat penting dalam kimia organik.
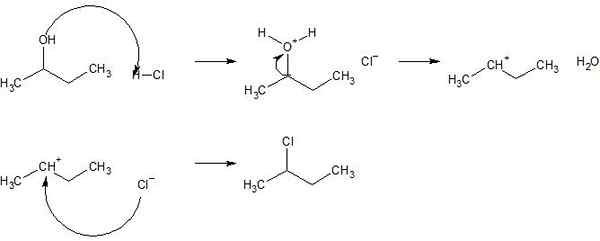
Rajah 02: Mekanisme tindak balas penggantian untuk 2-chlorobutane
Selain itu, terdapat dua jenis tindak balas penggantian sebagai tindak balas penggantian elektrofilik dan tindak balas penggantian nukleofilik. Walau bagaimanapun, terdapat juga kategori lain; itulah reaksi penggantian radikal.
Apakah perbezaan antara tindak balas sintesis dan tindak balas penggantian?
Reaksi sintesis dan tindak balas penggantian adalah tindak balas kimia yang penting dalam kimia organik. Perbezaan utama antara tindak balas sintesis dan tindak balas penggantian ialah tindak balas sintesis memberikan sebatian kimia baru yang terbentuk daripada gabungan reaktan, sedangkan tindak balas penggantian memberikan sebatian kimia yang diperolehi dari sebatian kimia yang ada. Contoh tindak balas sintesis adalah gabungan gas hidrogen dan gas oksigen untuk membentuk molekul air manakala contoh tindak balas penggantian adalah tindak balas pencawang elektrofilik 2-chlorobutane.
Infographic berikut menunjukkan lebih banyak perbandingan antara kedua -dua tindak balas untuk membezakan perbezaan antara tindak balas sintesis dan tindak balas penggantian.
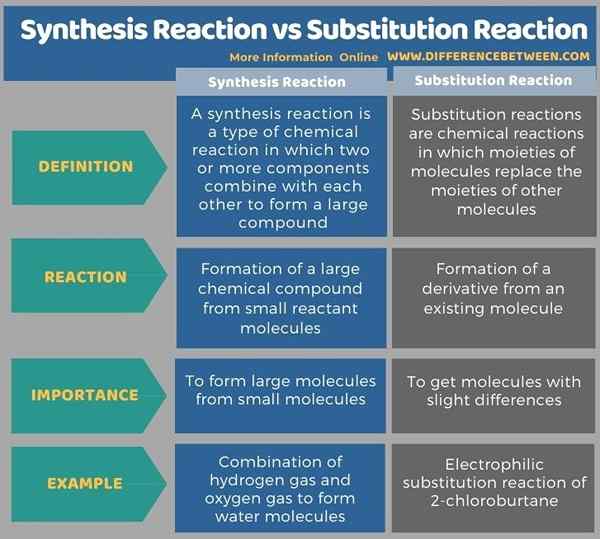
Ringkasan -Reaksi sintesis vs reaksi penggantian
Reaksi sintesis dan tindak balas penggantian adalah tindak balas kimia yang penting dalam kimia organik. Ringkas.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi tindak balas penggantian."Thoughtco, Feb. 11, 2020, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Penerangan tindak balas sintesis ditambah contoh."Thoughtco, Feb. 11, 2020, boleh didapati di sini.
Ihsan gambar:
1. "Reaksi Sintesis Lophine" oleh ADAM001D di Wikipedia Poland (CC oleh 3.0) melalui Commons Wikimedia
2. "2 Mekanisme Penggantian Chlorobutane" oleh Ajoyce7 - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia