Perbezaan antara hibridisasi SP3D2 dan D2SP3
Perbezaan utama - SP3D2 vs D2SP3 Hibridisasi
Terdapat struktur hipotetikal yang dikenali sebagai orbital dalam atom di mana elektron berada. Penemuan saintifik yang berbeza telah mencadangkan bentuk yang berbeza untuk orbital ini. Orbital atom boleh menjalani proses yang dikenali sebagai hibridisasi. Hibridisasi orbital berlaku untuk mendapatkan bentuk yang sesuai yang diperlukan untuk ikatan kimia. Hibridisasi adalah pencampuran orbital atom untuk membentuk orbital hibrid. sp3d2 dan d2sp3 adalah orbital hibrid seperti itu. The Perbezaan utama antara sp3d2 dan d2sp3Hibridisasi adalah itu sp3d2 Hibridisasi melibatkan orbital atom shell elektron yang sama sedangkan d2sp3 Hibridisasi melibatkan orbital atom dua cengkerang elektron.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah hibridisasi sp3d2
3. Apa itu hibridisasi D2SP3
4. Persamaan antara hibridisasi SP3D2 dan D2SP3
5. Perbandingan sampingan - sp3d2 vs d2sp3 hibridisasi dalam bentuk tabular
6. Ringkasan
Apakah hibridisasi sp3d2
sp3d2 Hibridisasi adalah pencampuran orbital atom S, P dan D dari shell elektron yang sama untuk membentuk SP3d2 Orbital hibrid. Di sana, satu orbital atom, tiga orbital atom p dan dua orbital atom d bercampur antara satu sama lain. Pencampuran ini menghasilkan enam orbital hibrid dengan saiz dan bentuk yang sama tetapi berbeza dengan orientasi mereka.
Sp3d2 Orbital hibrid diatur dalam susunan octahedral. Orbital hibrid ini mempunyai 90o sudut antara dua orbital dalam susunan octahedral. Susunan octahedral memaparkan satah persegi yang mempunyai empat orbital hibrid dan dua orbital yang tersisa berorientasikan di atas dan di bawah satah persegi ini (tegak lurus ke satah ini).
Contoh
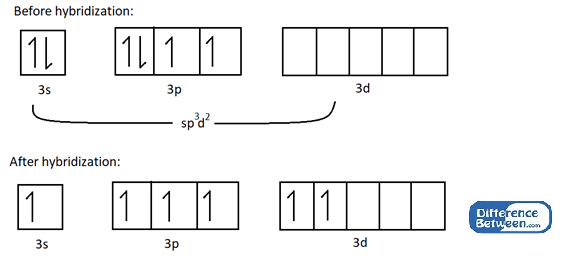
Mari kita pertimbangkan contoh untuk memahami SP3d2 Hibridisasi. Ex: Molekul SF6 mempunyai bentuk octahedral kerana orbital atom 3S, 3P dan 3D atom sulfur bercampur dengan Formsp3d2 Orbital hibrid.

Rajah 01: Struktur elektronik atom sulfur sebelum dan selepas hibridisasi.
Seperti yang ditunjukkan dalam imej di atas, hibridisasi menghasilkan enam elektron yang tidak berpasangan yang boleh mengambil bahagian dalam ikatan kimia dengan enam atom fluorin. Paling penting, semua orbital atom yang terlibat dalam hibridisasi ini berada dalam shell elektron yang sama (dalam contoh di atas, ia adalah n = 3 shell elektron).
Apa itu hibridisasi D2SP3?
d2sp3 Hibridisasi adalah pencampuran orbital atom S dan P dari shell elektron yang sama dengan orbital d orbital shell elektron lain untuk membentuk d2sp3 Orbital hibrid. Hibridisasi ini menghasilkan enam orbital hibrid. Orbital hibrid ini disusun dalam geometri octahedral.
Paling penting, dalam hibridisasi ini, orbital atom D berasal dari shell elektron yang berbeza (shell elektron n-1) manakala orbital atom S dan P adalah cangkang elektron yang sama. Marilah kita mempertimbangkan contoh untuk memahami hibrida ini. Kebanyakan kompleks ion logam terdiri daripada d2sp3 orbital hibrid.
Contoh
Sebagai contoh, ambil CO (NH3)3+ kompleks.
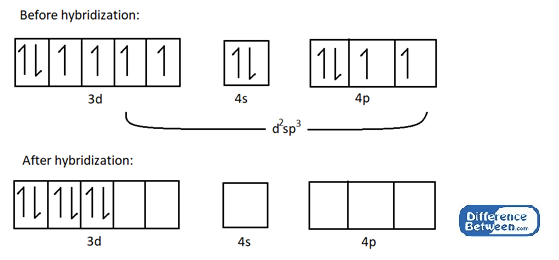
Rajah 02: Struktur elektronik kobalt (Co) atom sebelum dan selepas hibridisasi.
Seperti yang ditunjukkan dalam imej di atas, terdapat enam orbital hibrid kosong dalam atom kobalt selepas hibridisasi. Orbital kosong ini boleh mengambil bahagian dalam pembentukan ikatan kimia koordinasi dengan ligan (di sini ligan ammonia = NH3).
Apakah persamaan antara hibridisasi SP3D2 dan D2SP3?
- Kedua -dua hibridisasi SP3D2 dan D2SP3 menghasilkan geometri octahedral.
- Kedua -dua geometri hibridisasi SP3D2 dan D2SP3 mempunyai 90o sudut antara orbital hibrid.
- Kedua -dua hibridisasi SP3D2 dan D2SP3 menghasilkan enam orbital hibrid.
Apakah perbezaan antara hibridisasi SP3D2 dan D2SP3?
SP3D2 vs D2SP3 Hibridisasi | |
| sp3d2 Hibridisasi adalah pencampuran orbital atom S, P dan D dari shell elektron yang sama untuk membentuk SP3d2 Orbital hibrid. | d2sp3 Hibridisasi adalah pencampuran orbital atom S dan P dari shell elektron yang sama dengan orbital d orbital shell elektron lain untuk membentuk d2sp3 Orbital hibrid. |
| Nomenclature | |
| sp3d2 Hibridisasi membentuk sp3d2Orbital hibrid. | d2sp3 Hibridisasi d2sp3 Orbital hibrid. |
| Jenis orbital atom | |
| sp3d2 Hibridisasi melibatkan orbital atom dari cangkang elektron yang sama. | d2sp3 Hibridisasi melibatkan orbital atom dua cengkerang elektron. |
| d orbital | |
| sp3d2 Hibridisasi melibatkan orbital atom D dari n elektron shell. | d2sp3 Hibridisasi melibatkan orbital atom D dari shell elektron N-1. |
Ringkasan - SP3D2 vs D2SP3 Hibridisasi
sp3d2 hibridisasi dan d2sp3 Hibridisasi adalah istilah yang mengelirukan yang paling banyak digunakan secara beransur -ansur. Ini berbeza dengan banyak cara. Perbezaan utama antara SP3d2 dan d2sp3Hibridisasi adalah, SP3d2 Hibridisasi melibatkan orbital atom shell elektron yang sama sedangkan d2sp3 Hibridisasi melibatkan orbital atom dua cengkerang elektron.
Muat turun versi pdf sp3d2 vs d2sp3 hibridisasi
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi PDF di sini: Perbezaan antara hibridisasi SP3D2 dan D2SP3
Rujukan:
1."8.2: Orbital atom hibrid."Kimia Libretexts, Libretexts, 30 Ogos. 2017. Terdapat di sini


