Perbezaan antara tenaga solvation dan tenaga kekisi
Perbezaan utama - tenaga solvation vs Tenaga kekisi
Solvation Energy adalah perubahan dalam tenaga Gibbs pelarut apabila larut dibubarkan dalam pelarut itu. Tenaga kekisi adalah sama ada jumlah tenaga yang dikeluarkan semasa pembentukan kekisi dari ion atau jumlah tenaga yang diperlukan untuk memecahkan kisi. The Perbezaan utama Antara tenaga solvation dan tenaga kekisi ialah Solvation Energy memberikan perubahan entalpi apabila melarutkan larutan dalam pelarut manakala tenaga kekisi memberikan perubahan entalpi apabila pembentukan (atau kerosakan) kekisi.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu tenaga solvation
3. Apa itu Tenaga Kekisi
4. Perbandingan sampingan - Solvation Energy vs Tenaga kekisi dalam bentuk jadual
5. Ringkasan
Apa itu tenaga solvation?
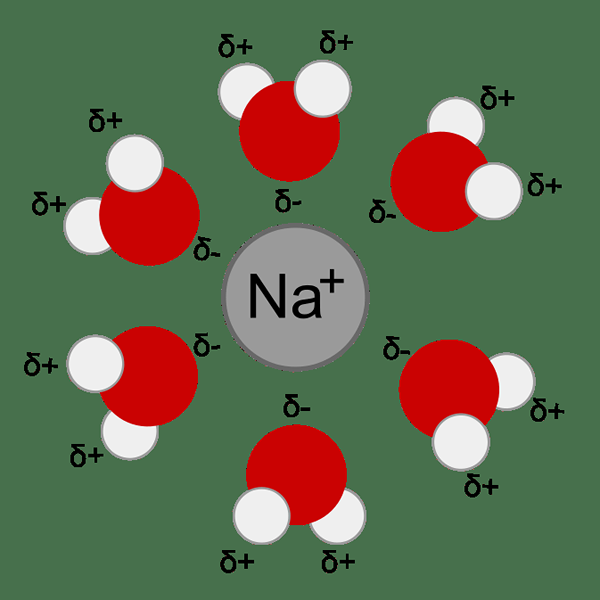
Solvation Energy adalah perubahan tenaga Gibbs apabila ion atau molekul dipindahkan dari vakum (atau fasa gas) ke pelarut. Solvation adalah interaksi antara pelarut dan molekul atau ion larut. Larut adalah sebatian yang akan dibubarkan dalam pelarut. Beberapa larutan terdiri daripada molekul manakala beberapa mengandungi ion.
Interaksi antara zarah pelarut dan larut menentukan banyak sifat larut. Cth: Kelarutan, kereaktifan, warna, dll. Semasa proses solvation, zarah larut dikelilingi oleh molekul pelarut yang membentuk kompleks solvation. Apabila pelarut yang terlibat dalam solvation ini adalah air, proses itu dipanggil penghidratan.
Pelbagai jenis ikatan dan interaksi kimia terbentuk semasa proses solvation; ikatan hidrogen, interaksi ion-dipole dan daya van der waal. Sifat pelarut pelarut dan larut menentukan kelarutan larut dalam pelarut. Sebagai contoh, polariti adalah faktor utama yang menentukan kelarutan larut dalam pelarut. Larutan kutub dibubarkan dengan baik dalam pelarut kutub. Larutan nonpolar dibubarkan dengan baik dalam pelarut nonpolar. Tetapi kelarutan larutan kutub dalam pelarut nonpolar (dan sebaliknya) adalah miskin.

Rajah 01: Solvation of a natrium kation di dalam air
Ketika datang ke termodinamik, solvation mungkin (spontan) hanya jika tenaga Gibbs penyelesaian akhir lebih rendah daripada tenaga Gibbs individu pelarut dan larut. Oleh itu, tenaga bebas Gibbs harus menjadi nilai negatif (tenaga bebas Gibbs sistem harus dikurangkan setelah pembentukan penyelesaiannya). Solvation merangkumi langkah yang berbeza dengan tenaga yang berbeza.
- Pembentukan rongga pelarut untuk membuat ruang untuk larutan. Ini termodinamik tidak menguntungkan kerana apabila interaksi antara molekul pelarut menurun, dan entropi menurun.
- Pemisahan zarah larut dari pukal juga termodinamik tidak menguntungkan. Itu kerana interaksi larut-solute menurun.
- Interaksi pelarut-pelarut berlaku apabila larut memasuki rongga pelarut adalah termodinamik yang baik.
Tenaga solvation juga dikenali sebagai enthalpy solvation. Adalah berguna untuk menjelaskan pembubaran beberapa kisi dalam pelarut sementara beberapa kisi tidak. Perubahan entalpi penyelesaian adalah perbezaan antara tenaga melepaskan larut dari pukal dan menggabungkan larut dengan pelarut. Sekiranya ion mempunyai nilai negatif untuk perubahan entalpi penyelesaian, ia menunjukkan bahawa ion lebih cenderung untuk membubarkan pelarut itu. Nilai positif yang tinggi menunjukkan bahawa ion kurang cenderung untuk membubarkan.
Apa itu Tenaga Kekisi?
Tenaga Kekisi adalah ukuran tenaga yang terkandung dalam kekisi kristal sebatian, sama dengan tenaga yang akan dibebaskan jika ion komponen dibawa bersama dari tak terhingga. Tenaga kekisi sebatian juga boleh ditakrifkan sebagai jumlah tenaga yang diperlukan untuk memecahkan pepejal ionik ke dalam atomnya dalam fasa gas.
Pepejal ionik adalah sebatian yang sangat stabil kerana enthalpies pembentukan molekul ionik bersama -sama dengan kestabilan kerana tenaga kisi struktur pepejal. Tetapi tenaga kekisi tidak dapat diukur secara eksperimen. Oleh itu, a Kitaran lahir-haber digunakan untuk menentukan tenaga kisi pepejal ionik. Terdapat beberapa istilah yang perlu difahami sebelum melukis kitaran yang dilahirkan.
- Tenaga Pengionan - Jumlah tenaga yang diperlukan untuk mengeluarkan elektron dari atom neutral dalam gas
- Affinity Elektron - Jumlah tenaga yang dikeluarkan apabila elektron ditambah kepada atom neutral di gas
- Tenaga Pemisahan - Jumlah tenaga yang diperlukan untuk memecahkan sebatian ke dalam atom atau ion.
- Tenaga Sublimasi - Jumlah tenaga yang diperlukan untuk menukar pepejal ke dalam wapnya
- Haba pembentukan - perubahan tenaga apabila sebatian terbentuk dari unsur -unsurnya.
- Undang -undang Hess - undang -undang yang menyatakan bahawa perubahan keseluruhan tenaga proses tertentu dapat ditentukan dengan melanggar proses ke langkah -langkah yang berbeza.
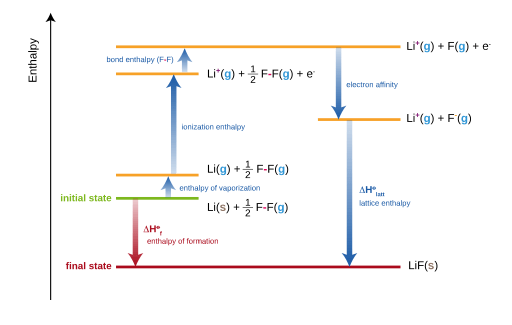
Rajah 02: Kitaran yang dilahirkan untuk pembentukan litium fluorida (LIF)
Kitaran yang dilahirkan boleh diberikan oleh persamaan berikut.
Haba pembentukan = haba pengabosan + tenaga pemisahan + jumlah tenaga pengionan + jumlah afinitas elektron + tenaga kekisi
Maka tenaga kekisi sebatian dapat diperoleh dengan menyusun semula persamaan ini seperti berikut.
Kekisi tenaga = haba pembentukan - haba pengabosan + tenaga pemisahan + jumlah tenaga pengionan + jumlah afiniti elektron
Apakah perbezaan antara tenaga solvation dan tenaga kekisi?
Tenaga solvation vs tenaga kekisi | |
| Solvation Energy adalah perubahan tenaga Gibbs apabila ion atau molekul dipindahkan dari vakum (atau fasa gas) ke pelarut. | Tenaga Kekisi adalah ukuran tenaga yang terkandung dalam kekisi kristal sebatian, sama dengan tenaga yang akan dibebaskan jika ion komponen dibawa bersama dari tak terhingga. |
| Prinsip | |
| Solvation Energy memberikan perubahan entalpi apabila melarutkan larutan dalam pelarut. | Tenaga kekisi memberikan perubahan entalpi apabila pembentukan (atau kerosakan) kekisi. |
Ringkasan - Tenaga solvation vs Tenaga kekisi
Solvation Energy adalah perubahan entalpi sistem semasa larutan larut dalam pelarut. Tenaga kekisi adalah jumlah tenaga yang dikeluarkan semasa pembentukan kekisi atau jumlah tenaga yang diperlukan untuk memecahkan kekisi. Perbezaan antara tenaga solvation dan tenaga kekisi adalah bahawa tenaga solvation memberikan perubahan entalpi apabila melarutkan larut dalam pelarut manakala tenaga kisi memberikan perubahan entalpi apabila pembentukan (atau kerosakan) kekisi.
Rujukan:
1."Tenaga kekisi."Chem.Purdue.edu. Terdapat di sini
2.Kesatuan Antarabangsa Kimia Tulen dan Gunaan. "Solvation Energy."Buku Emas IUPAC - Solvation Energy. Terdapat di sini
3."Solvation."Wikipedia, Yayasan Wikimedia, 5 Mac. 2018. Terdapat di sini
Ihsan gambar:
1.'Na+H2O'By Taxman (Domain Awam) melalui Commons Wikimedia
2.'Cycle Born-Haber Lif'by Jkwchui-Kerja Sendiri, (CC BY-SA 3.0) melalui Commons Wikimedia


