Perbezaan antara garam larut dan tidak larut

The Perbezaan utama antara garam larut dan tidak larut adalah bahawa Garam larut boleh larut dalam air pada suhu bilik, sedangkan garam tidak larut tidak dapat dibubarkan di dalam air pada suhu bilik.
Garam adalah sebatian yang terbentuk daripada tindak balas antara asid dan asas. Oleh itu, garam pada dasarnya mengandungi anion (berasal dari asid) dan kation (berasal dari asas). Kita boleh membahagikan sebatian garam menjadi dua jenis bergantung kepada kelarutan air mereka pada suhu bilik. Mereka larut dan garam tidak larut. Kelarutan garam bergantung kepada jenis interaksi yang mereka dapat dengan molekul air.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah garam larut
3. Apakah garam yang tidak larut
4. Perbandingan sampingan - larut vs garam tidak larut dalam bentuk jadual
5. Ringkasan
Apakah garam larut?
Garam larut adalah sebatian garam yang larut dalam air pada suhu bilik. Sebatian garam ini dibubarkan di dalam air kerana mereka boleh membentuk tarikan intermolecular dengan molekul air. Molekul air adalah kutub. Oleh itu, air adalah pelarut kutub, dan garam kutub dapat dibubarkan di dalam air.

Rajah 01: Natrium klorida adalah garam larut
Oleh kerana garam adalah sebatian ionik, mereka larut dalam air kerana molekul air cenderung menarik ion di dalam kompaun, yang menjadikannya terpisah dari satu sama lain, mengakibatkan pembubaran garam. Di sini, pembubaran garam membentuk spesies ionik di dalam air, yang menjadikan larutan berair yang baru terbentuk sangat konduktif. Spesies ionik yang dibubarkan di dalam air dapat menjalankan elektrik melaluinya. Contoh garam larut adalah garam meja atau natrium klorida. Penyelesaian garam meja berair mengandungi ion natrium dan ion klorida.
Apakah garam yang tidak larut?
Garam yang tidak larut adalah sebatian garam yang tidak larut dalam air pada suhu bilik. Ini tidak larut dalam air kerana molekul air tidak dapat menarik ion di kawasan garam. Oleh itu, tidak ada interaksi intermolecular antara molekul air dan sebatian garam yang tidak larut.

Rajah 02: Perak klorida mendakan di dalam air
Tambahan pula, garam tidak larut adalah sebatian nonpolar. Tidak seperti garam larut, pencampuran garam tidak larut dengan air tidak menjadikan larutan konduktif kerana garam tidak memisahkan ke dalam ion. Contoh yang baik dari garam yang tidak larut adalah klorida perak (AGCL).
Apakah perbezaan antara garam larut dan tidak larut?
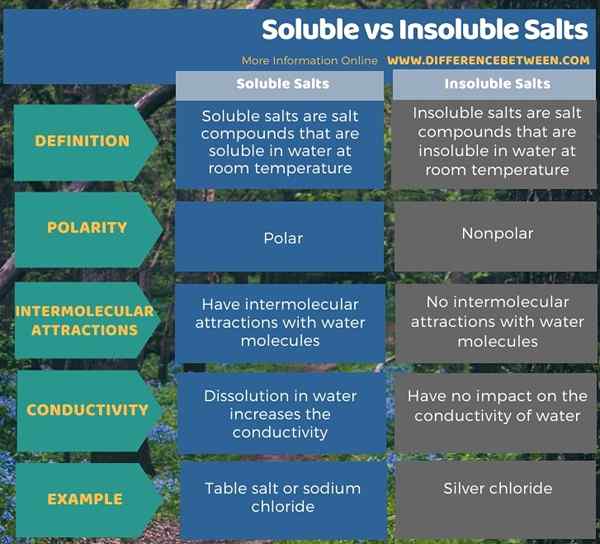
Kita boleh membahagikan sebatian garam menjadi dua jenis bergantung pada kelarutan air mereka. Mereka larut dan garam tidak larut. Perbezaan utama antara garam larut dan tidak larut adalah bahawa garam larut boleh larut dalam air pada suhu bilik, sedangkan garam tidak larut tidak dapat dibubarkan di dalam air pada suhu bilik. Selain itu, garam larut adalah kutub; Itulah sebabnya mereka boleh larut dalam air, yang merupakan pelarut kutub. Sebaliknya, garam yang tidak larut adalah nonpolar. Oleh itu, ini adalah satu lagi perbezaan yang signifikan antara garam larut dan tidak larut.
Sebagai tambahan kepada perkara di atas, molekul air boleh membentuk tarikan intermolecular dengan ion garam larut, tetapi tidak ada interaksi intermolecular antara garam dan air yang tidak larut. Selain itu, pembubaran garam larut di dalam air menjadikan larutan berair yang sangat konduktif kerana ion -ion yang dibubarkan di dalam air dapat menjalankan elektrik melaluinya. Tidak seperti garam larut, mencampurkan garam tidak larut dengan air tidak membuat air konduktif. Natrium klorida adalah contoh garam larut, sedangkan klorida perak adalah contoh untuk garam tidak larut.
Ringkasan -Garam larut vs tidak larut
Kita boleh membahagikan sebatian garam menjadi dua jenis bergantung pada kelarutan air mereka. Mereka larut dan garam tidak larut. Perbezaan utama antara garam larut dan tidak larut adalah bahawa garam larut boleh larut dalam air pada suhu bilik, sedangkan garam tidak larut tidak dapat dibubarkan di dalam air pada suhu bilik. Selain itu, garam larut adalah kutub; Itulah sebabnya mereka boleh larut dalam air, yang merupakan pelarut kutub. Sebaliknya, garam yang tidak larut adalah nonpolar.
Rujukan:
1. "Garam tidak larut."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
2. "Definisi garam yang tidak larut (precipitates)."Kamus Cehmicool, boleh didapati di sini.
3. "Garam tidak larut."Garam-tripod, boleh didapati di sini.
Ihsan gambar:
1. "Natrium Klorida" oleh ChemicalInterest - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Silver Chloride (AGCL)" oleh Luisbrudna - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


