Perbezaan Antara Undang -undang Raoult dan Undang -undang Dalton
The Perbezaan utama Antara undang -undang Raoult dan undang -undang Dalton ialah Undang-undang Raoult berkaitan dengan tekanan wap pepejal atau cecair, sedangkan undang-undang Dalton menangani tekanan separa gas yang tidak bertindak balas.
Undang -undang Raoult dan undang -undang Dalton adalah undang -undang yang sangat penting dalam kimia yang menjelaskan tekanan separa negara -negara gas. Undang -undang Raoult menerangkan tingkah laku tekanan separa wap penyelesaian apabila menukar kepekatan larut. Sebaliknya, undang-undang Dalton menerangkan tingkah laku gas yang tidak bertindak balas di dalam kapal yang sama.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu undang -undang raoult
3. Apa itu Undang -undang Dalton
4. Perbandingan sampingan - Undang -undang Raoult vs Dalton Law dalam bentuk jadual
6. Ringkasan
Apa itu undang -undang raoult?
Undang -undang Raoult menyatakan bahawa tekanan wap pelarut di atas larutan adalah sama dengan tekanan wap pelarut tulen pada suhu yang sama skala oleh pecahan tahi lalat yang ada dalam larutan. Kita boleh memberikan hubungan ini secara matematik seperti berikut:
Ppenyelesaian= Xpelarut.Popelarut
Di mana psoltuion Adakah tekanan wap penyelesaian, xpelarut adalah pecahan tahi lalat pelarut dan popelarut Adakah tekanan wap pelarut tulen. Undang-undang ini dibangunkan oleh ahli kimia Perancis, François-Marie Raoult pada tahun 1880. Dia mendapati bahawa apabila menambah larutan ke penyelesaian, tekanan wap penyelesaiannya secara beransur -ansur berkurangan. Walau bagaimanapun, pemerhatian ini bergantung kepada dua pembolehubah: pecahan tahi lalat dan tekanan wap terlarut pelarut tulen.
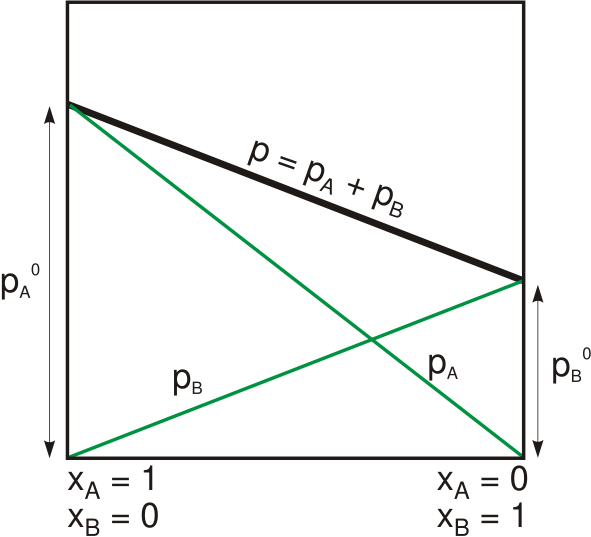
Rajah 01: Tekanan wap penyelesaian binari yang mengikuti undang -undang Raoult
Pada tekanan yang diberikan untuk pepejal atau cecair tertentu, terdapat tekanan di mana wap bahan berada dalam keseimbangan dengan bahan dalam bentuk pepejal atau cecair. Pada suhu itu, kita namakan tekanan di atas bahan sebagai tekanan wap. Selain itu, pada keseimbangan ini, kadar penyejatan bahan pepejal atau cecair adalah sama dengan wap yang memendekkan kembali ke bentuk pepejal atau cecair. Oleh itu, ini adalah teori asas di sebalik undang -undang raoult. Walau bagaimanapun, undang -undang Raoult berfungsi untuk penyelesaian yang ideal. Tetapi ia juga berfungsi dengan baik dengan pelarut dalam keadaan yang sangat cair. Untuk bahan sebenar (bukan bahan yang ideal), penurunan tekanan wap praktikal lebih besar daripada nilai yang kita hitung dari undang -undang raoult.
Apa itu Undang -undang Dalton?
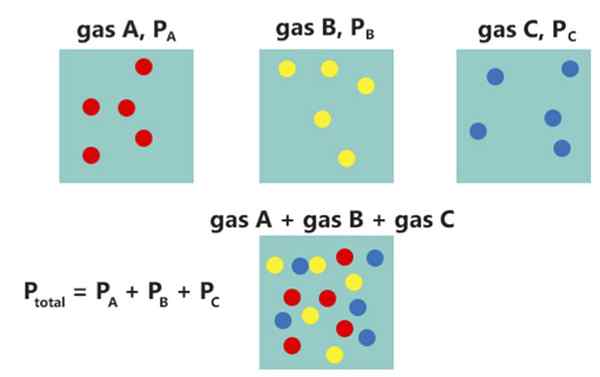
Undang-undang Dalton menyatakan bahawa jumlah tekanan campuran gas tidak bertindak balas adalah sama dengan jumlah tekanan separa setiap gas. Undang -undang itu dibangunkan oleh John Dalton pada tahun 1802. Kita boleh memberikan undang -undang ini secara matematik seperti berikut:
PJumlah= Pi
Di mana pJumlah adalah jumlah tekanan campuran gas sementara pi adalah tekanan separa setiap gas individu.

Rajah 02: Undang -undang Dalton
Sebagai contoh, jika kita mempunyai campuran gas yang tidak bertindak balas dengan tiga komponen di dalamnya, kita boleh menulis hubungan seperti berikut:
PJumlah = P1+P2+P3
Apakah perbezaan antara undang -undang Raoult dan undang -undang Dalton?
Undang -undang Raoult dan Undang -undang Dalton adalah undang -undang yang sangat penting dalam kimia yang menjelaskan tekanan sebahagian daripada negara -negara gas. Perbezaan utama antara undang-undang Raoult dan undang-undang Dalton adalah bahawa undang-undang Raoult berkaitan dengan tekanan wap pepejal atau cecair, sedangkan undang-undang Dalton menangani tekanan separa gas yang tidak bertindak balas. Itu dia; Undang -undang Raoult menyatakan bahawa tekanan wap pelarut di atas larutan adalah sama dengan tekanan wap pelarut tulen pada suhu yang sama skala oleh pecahan tahi lalat yang ada dalam larutan. Sementara itu, undang-undang Dalton menyatakan bahawa jumlah tekanan campuran gas tidak bertindak balas sama dengan jumlah tekanan separa setiap gas. Ekspresi matematik untuk undang -undang raoult adalah ppenyelesaian= Xpelarut.Popelarut Walaupun ungkapan matematik untuk undang -undang Dalton adalah pJumlah= Pi.

Ringkasan -Undang -undang Raoult vs Dalton Law
Undang -undang Raoult dan Undang -undang Dalton adalah undang -undang yang sangat penting dalam kimia yang menjelaskan tekanan sebahagian daripada negara -negara gas. Walau bagaimanapun, perbezaan utama antara undang-undang Raoult dan undang-undang Dalton adalah bahawa undang-undang Raoult berkaitan dengan tekanan wap pepejal atau cecair, sedangkan undang-undang Dalton menangani tekanan separa gas yang tidak bertindak balas.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi undang -undang Raoult dalam kimia."Thoughtco, Jan. 9, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Raoultov Zakon" (domain awam) melalui Commons Wikimedia
2. "Skema yang menggambarkan undang -undang Dalton" oleh Blyumj - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


