Perbezaan antara orbital tulen dan hibrid
The Perbezaan utama antara orbital murni dan hibrid adalah bahawa Orbital tulen adalah orbital atom asal sedangkan orbital hibrid terbentuk dari pencampuran dua atau lebih orbital atom.
Dalam pembentukan ikatan kimia molekul mudah, kita hanya dapat mempertimbangkan pertindihan orbital atom. Tetapi jika kita harus membincangkan ikatan kimia dalam molekul kompleks, kita perlu tahu apakah hibrida orbital. Hibridisasi orbital adalah konsep kimia yang menggambarkan pencampuran orbital atom untuk membentuk orbital hibrid baru. Orbital ini melibatkan pembentukan ikatan kimia kovalen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu orbital murni
3. Apakah orbital hibrid
4. Perbandingan sampingan - orbital hibrid murni vs dalam bentuk jadual
5. Ringkasan
Apa itu orbital murni?
Orbital tulen adalah orbital atom yang mengandungi elektron atom. Orbital ini bukan orbital bercampur seperti orbital hibrid. Orbital memberikan lokasi elektron yang paling mungkin dalam atom kerana elektron berada dalam pergerakan berterusan di sekitar nukleus atom. Daripada lokasi tetap, ini memberikan kawasan di mana elektron boleh berlaku pada masa tertentu.
Orbital atom tulen wujud dalam beberapa bentuk seperti bentuk sfera, bentuk dumbbell. Menurut mekanik kuantum, terdapat satu set nombor kuantum yang kami gunakan untuk menamakan orbital. Set nombor ini termasuk n (nombor kuantum utama), l (nombor kuantum momentum sudut), m (nombor kuantum magnet) dan s (nombor kuantum putaran). Setiap orbital menduduki maksimum dua elektron. Menurut bilangan kuantum momentum sudut, terdapat empat orbital atom yang biasa dikenali sebagai orbital s (berbentuk sfera), p orbital (berbentuk dumbbell), d orbital (dua dumbbells dalam satah yang sama) dan f orbital (struktur rumit).
Apakah orbital hibrid?
Orbital hibrid adalah orbital molekul yang terbentuk dari pencampuran orbital atom. Ini adalah orbital hipotesis. Pencampuran berlaku di antara orbital atom atom yang sama. pencampuran ini berlaku untuk membentuk ikatan kimia kovalen dengan atom lain. Proses pencampuran ini adalah "hibridisasi orbital" yang mengakibatkan orbital hibrid. Kami namakan orbital ini mengikut orbital atom yang menjalani hibridisasi.

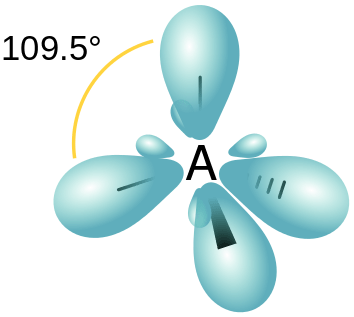
Rajah 01: Hibridisasi SP3
Oleh itu, tiga bentuk utama orbital hibrid adalah:
- SP Hibrid Orbital - Bentuk ini disebabkan oleh hibridisasi orbital atom S dan P. Oleh itu orbital hibrid yang dihasilkan mempunyai ciri -ciri 50% dan ciri -ciri orbital 50%. Orbital hibrid ini mempunyai susunan ruang linear.
- sp2 Orbital Hibrid - Bentuk ini disebabkan oleh hibridisasi satu s dan dua orbital P. Oleh itu orbital hibrid yang dihasilkan mempunyai 33% ciri orbital s dan 66% ciri orbital p. Susunan ruang adalah planar trigonal.
- sp3 Orbital Hibrid - Bentuk ini disebabkan oleh hibridisasi satu s dan tiga orbital P. Oleh itu orbital hibrid yang dihasilkan mempunyai ciri -ciri 25% dan ciri -ciri 75%. Susunan ruang orbital hibrid ini adalah tetrahedral.
Apakah perbezaan antara orbital murni dan hibrid?
Orbital tulen adalah orbital atom yang mengandungi elektron atom manakala orbital hibrid adalah orbital molekul yang terbentuk dari pencampuran orbital atom. Ini adalah perbezaan utama antara orbital tulen dan hibrid. Tambahan pula, orbital hibrid membentuk melalui hibridisasi orbital, tetapi orbital tulen tidak hibrid. Selain itu, pembentukan orbital hibrid adalah penting dalam pembentukan sebatian kimia rumit melalui pembentukan ikatan kimia kovalen. Semasa mempertimbangkan tatanama orbital, kami menamakan orbital tulen sebagai orbital s, p, d dan f semasa kami menamakan orbital hibrid sebagai sp, sp, sp, sp2, sp3, dan lain-lain.
Infographic di bawah ini membezakan perbezaan antara orbital tulen dan hibrid untuk rujukan pantas.
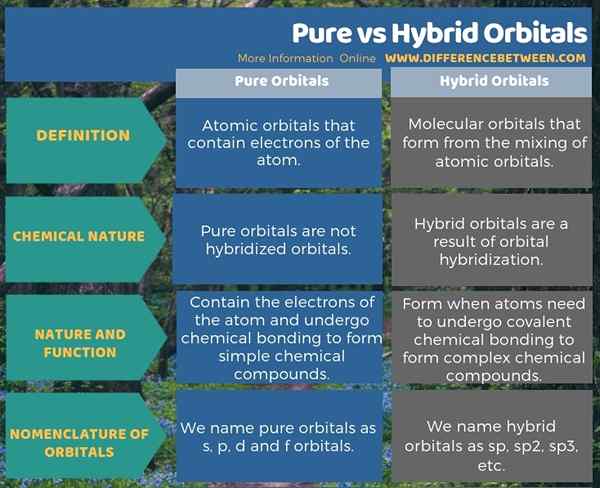
Ringkasan -orbital hibrid murni vs
Orbital atom adalah kawasan di mana elektron wujud dalam atom. Dalam artikel ini, kami menggambarkan dua jenis orbital sebagai orbital murni dan hibrid. Perbezaan utama antara orbital murni dan hibrid adalah bahawa orbital tulen adalah orbital atom asal manakala orbital hibrid terbentuk dari pencampuran dua atau lebih orbital atom.
Rujukan:
1. Libretexts. "Orbital hibrid."Kimia Libretexts, Libretexts, 21 Julai 2016. Terdapat di sini
Ihsan gambar:
1."AE4H" oleh JFMelero - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


