Perbezaan antara pelarut protik dan aprotik

Perbezaan utama - Protik vs Aprotik Pelarut
The Perbezaan utama Antara pelarut protik dan aprotik ialah Pelarut protik mempunyai atom hidrogen yang dissociable manakala pelarut aprotik tidak mempunyai atom hidrogen yang disosialisasikan.
Pelarut adalah sebatian cecair yang dapat membubarkan bahan lain. Terdapat pelbagai bentuk pelarut yang boleh dikategorikan pada dasarnya ke dalam dua kumpulan sebagai pelarut kutub dan nonpolar. Pelarut kutub boleh dibahagikan kepada dua kumpulan sebagai pelarut protik dan aprotik. Pelarut protik boleh membentuk ikatan hidrogen kerana mereka mempunyai ikatan kimia yang diperlukan untuk ikatan hidrogen, i.e. Ikatan o-h dan ikatan n-h. Sebaliknya, pelarut aprotik kekurangan ikatan kimia yang diperlukan untuk ikatan hidrogen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu pelarut protik
3. Apakah pelarut aprotik
4. Persamaan antara pelarut protik dan aprotik
5. Perbandingan sampingan - Protik vs pelarut aprotik dalam bentuk jadual
6. Ringkasan
Apa itu pelarut protik?
Pelarut protik adalah sebatian cecair kutub yang mempunyai atom hidrogen yang dissociable. Pelarut ini mempunyai banyak bon O-H dan bon N-H. Atom hidrogen yang dissociable adalah yang terikat kepada atom oksigen dan atom nitrogen dalam ikatan O-H dan N-H ini. Oleh itu, kumpulan hidroksil (-OH) dan kumpulan amina (-NH2) adalah komponen penting dalam pelarut protik.
Pelarut protik berkongsi kuasa melarutkan ion dengan pelarut aprotik dan berasid (kerana mereka boleh melepaskan proton). Pemalar dielektrik pelarut protik ini sangat tinggi (pemalar dielektrik adalah harta bahan penebat elektrik dan kuantiti mengukur keupayaan bahan untuk menyimpan tenaga elektrik dalam medan elektrik).
Contoh pelarut protik termasuk air, alkohol seperti metanol dan etanol, fluorida hidrogen (HF), dan ammonia (NH3). Pelarut ini sering digunakan untuk membubarkan garam. Pelarut protik kutub lebih suka menjalani tindak balas SN1.
Apakah pelarut aprotik?
Pelarut aprotik adalah sebatian cecair kutub yang tidak mempunyai atom hidrogen yang dissociable. Pelarut ini kekurangan BOD kimia seperti ikatan O-H dan ikatan N-H. Oleh itu, pelarut aprotik kekurangan kumpulan hidroksil (-OH) dan kumpulan amina (-NH2) dan tidak dapat membentuk ikatan hidrogen.
Pelarut aprotik berkongsi kuasa melarutkan ion dengan pelarut protik. Pelarut aprotik ini tidak mempunyai hidrogen berasid, oleh itu tidak banyak pelepasan ion hidrogen. Pelarut aprotik polar mempunyai nilai malar dielektrik rendah atau pertengahan. Pelarut ini menunjukkan polariti sederhana.
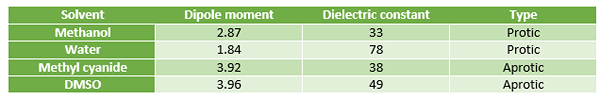
Rajah 01: Perbandingan antara pelarut protik dan aprotik
Contoh pelarut aprotik termasuk dichloromethane (DCM), tetrahydrofuran (THF), etil asetat, dan aseton. Pelarut aprotik boleh digunakan untuk membubarkan garam. Pelarut ini lebih suka menjalani tindak balas SN2.
Apakah persamaan antara pelarut protik dan aprotik?
- Kedua -dua pelarut protik dan aprotik adalah pelarut kutub.
- Kedua -dua pelarut pelarut protik dan aprotik dapat membubarkan garam.
Apakah perbezaan antara pelarut protik dan aprotik?
Pelarut protik vs aprotik | |
| Pelarut protik adalah sebatian cecair kutub yang mempunyai atom hidrogen yang dissociable. | Pelarut aprotik adalah sebatian cecair kutub yang tidak mempunyai atom hidrogen yang dissociable. |
| Pembentukan ikatan hidrogen | |
| Pelarut protik mampu pembentukan ikatan hidrogen. | Pelarut aprotik tidak dapat membentuk ikatan hidrogen. |
| Keasidan | |
| Pelarut protik berasid. | Pelarut aprotik tidak berasid. |
| Ikatan kimia hadir | |
| Pelarut protik kaya dengan bon O-H dan ikatan N-H. | Pelarut aprotik kekurangan bon O-H dan ikatan N-H. |
| Pemalar dielektrik | |
| Pelarut Protik mempunyai pemalar dielektrik yang tinggi. | Pelarut aprotik mempunyai pemalar dielektrik yang rendah. |
| Jenis tindak balas pilihan | |
| Pelarut protik lebih suka menjalani tindak balas SN1. | Pelarut aprotik lebih suka menjalani tindak balas SN2. |
Ringkasan -Protik vs Aprotik Pelarut
Pelarut adalah cecair yang mampu membubarkan bahan. Pelarut boleh didapati dalam dua bentuk utama sebagai pelarut kutub dan pelarut nonpolar. Pelarut kutub boleh dibahagikan lagi kepada dua kumpulan sebagai pelarut protik dan pelarut aprotik. Perbezaan antara pelarut protik dan aprotik ialah pelarut protik mempunyai atom hidrogen yang dissociable manakala pelarut aprotik tidak mempunyai atom hidrogen yang dissociable.
Rujukan:
1."Protik Polar? Polar Aprotik? Nonpolar? Semua mengenai pelarut."RSS Kimia Organik Master. Terdapat di sini
2."Pelarut Protik."Wikipedia, Yayasan Wikimedia, 17 Dis. 2017. Terdapat di sini
3."Pelarut aprotik dan protik."Scribd, Scribd. Terdapat di sini


