Perbezaan antara kelimpahan peratus dan kelimpahan relatif
Perbezaan utama - kelimpahan peratus vs kelimpahan relatif
Kelimpahan peratus dan kelimpahan relatif adalah nilai peratusan unsur -unsur kimia yang mewakili kejadian mereka di alam sekitar. Perbezaan utama antara kelimpahan peratus dan kelimpahan relatif ialah Kelimpahan peratus memberikan kelimpahan isotop manakala kelimpahan relatif memberikan kelimpahan unsur -unsur kimia. Kelimpahan peratus dapat digunakan untuk menentukan jisim atom rata -rata unsur kimia tertentu. Kelimpahan relatif memberikan berlakunya elemen kimia tertentu dalam persekitaran tertentu, i.e, di bumi.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Berapakah jumlah peratus
3. Apakah kelimpahan relatif
4. Persamaan antara kelimpahan peratus dan kelimpahan relatif
5. Perbandingan sampingan -kelimpahan peratus vs kelimpahan relatif dalam bentuk jadual
6. Ringkasan
Berapakah jumlah peratus?
Kelimpahan peratus adalah jumlah peratusan semua isotop yang berlaku secara semulajadi dari elemen. Isotop adalah atom elemen yang sama yang mempunyai nombor atom yang sama tetapi nombor jisim yang berbeza. Ini bermakna isotop adalah atom yang mempunyai bilangan proton yang sama dalam nukleus atom, tetapi bilangan neutron yang berlainan.
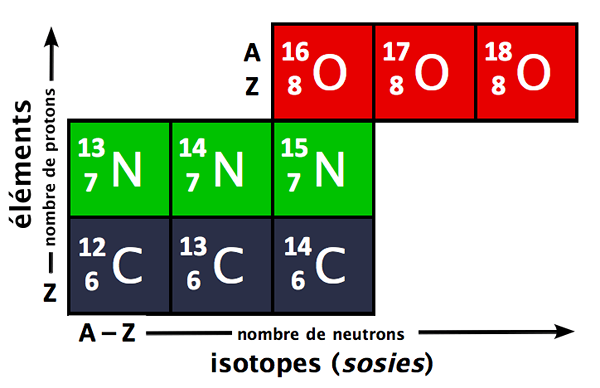
Rajah 1: Isotop unsur -unsur yang berbeza boleh digunakan untuk mencari purata atom mereka
Isotop setiap elemen berlaku secara semula jadi dalam nisbah yang berbeza. Kelimpahan peratus isotop menunjukkan kebarangkalian mencari isotop yang bersifat alam semesta boleh didapati sebagai campuran isotop. Kelimpahan peratus dapat digunakan untuk mencari jisim atom unsur. Jisim atom boleh didapati menggunakan persamaan berikut.
Purata jisim atom = Σ (jisim isotop x peratus kelimpahan isotop)
Marilah kita mempertimbangkan contoh untuk memahami perkara ini. Isotop klorin yang paling stabil dan semulajadi adalah CL-35 (jisim = 34.Kelimpahan 969 dan peratus = 75.53%) dan CL-37 (jisim = 36.Kelimpahan 966 dan peratus = 24.47%). Kemudian,
Jisim purata klorin = Σ (jisim isotop x peratus kelimpahan isotop)
= Σ (34.969 x 75.53/100) + (36.966 x 24.47/100)
= 26.412 amu + 9.045 amu
= 35.46 amu.
Apakah kelimpahan relatif?
Kelimpahan relatif elemen adalah ukuran berlakunya unsur relatif terhadap semua elemen lain di alam sekitar. Terdapat tiga cara untuk menentukan kelimpahan relatif unsur:
- Pecahan massa
- Pecahan mol
- Pecahan volum
Kaedah pecahan kelantangan adalah yang paling biasa untuk elemen gas dalam campuran gas, i.e, suasana bumi. Walau bagaimanapun, ekspresi kelimpahan yang paling relatif adalah pecahan massa.

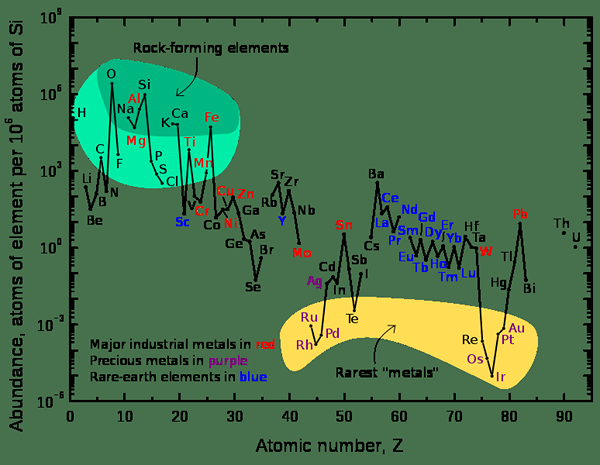
Rajah 2: Grafik yang menunjukkan banyak unsur -unsur relatif di kerak atas bumi
Apabila mempertimbangkan alam semesta, unsur -unsur kimia yang paling banyak adalah hidrogen dan helium. Apabila mempertimbangkan bumi, elemen yang paling biasa adalah besi yang peratusan jisimnya adalah 32.1%. Unsur lain adalah oksigen (32.1%), silikon (15.1%), magnesium (13.9%), sulfur (2.9%) dan unsur -unsur lain hadir dalam peratusan jejak.
Apakah persamaan antara kelimpahan peratus dan kelimpahan relatif?
- Kedua -dua peratus kelimpahan dan kelimpahan relatif adalah nilai peratusan.
- Kedua -dua peratus kelimpahan dan kelimpahan relatif menyatakan peratusan unsur kimia yang berbeza.
Berapakah perbezaan antara kelimpahan peratus dan kelimpahan relatif?
Kelimpahan peratus vs kelimpahan relatif | |
| Kelimpahan peratus adalah jumlah peratusan semua isotop yang berlaku secara semulajadi dari elemen. | Kelimpahan relatif elemen adalah peratusan berlakunya unsur relatif terhadap semua elemen lain di alam sekitar. |
| Perwakilan | |
| Kelimpahan peratus memberikan kelimpahan isotop. | Kelimpahan relatif memberikan banyak unsur kimia. |
Ringkasan -Kelimpahan peratus vs kelimpahan relatif
Kelimpahan peratus dan kelimpahan relatif adalah dua istilah yang digunakan untuk memberikan kelimpahan isotop dan elemen kimia. Perbezaan utama antara kelimpahan peratus dan kelimpahan relatif adalah bahawa kelimpahan peratus memberikan kelimpahan isotop manakala kelimpahan relatif memberikan kelimpahan unsur -unsur kimia.
Rujukan:
1. “Jisim atom rata -rata."Jisim atom purata, [dilindungi e -mel], tersedia di sini.
2. "Kelimpahan elemen kimia."Wikipedia, Yayasan Wikimedia, 25 Feb. 2018, boleh didapati di sini.
3. Simoes, Kristian. "Kelimpahan elemen kimia."Astrono, boleh didapati di sini.
Ihsan gambar:
1. "Isotope CNO" oleh Lucquessoy - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
2. "Kelimpahan Elemental" oleh Gordon B. Haxel, Sara Boore, dan Susan Mayfield dari USGS; Vektor oleh Pengguna: Michbich - (Domain Awam) melalui Commons Wikimedia