Perbezaan antara nombor pengoksidaan dan caj
The Perbezaan utama antara bilangan pengoksidaan dan caj ialah kita dapat menentukan bilangan pengoksidaan atom memandangkan bilangan elektron yang sama ada dikeluarkan atau diperolehi oleh atom itu sedangkan caj ditentukan memandangkan jumlah elektron dan proton dalam atom.
Unsur yang berbeza dalam jadual berkala mempamerkan ciri -ciri kimia dan fizikal yang berbeza. Dan apabila mereka bergabung untuk membentuk molekul, unsur -unsur yang berbeza bergabung dengan elemen lain dalam perkadaran yang berbeza. Antara sebilangan besar variasi antara unsur -unsur, parameter yang paling mudah dan penting adalah nombor caj dan pengoksidaan mereka. Caj dan bilangan pengoksidaan elemen membantu untuk mengenal pasti, yang mana kumpulan elemen ini tergolong dalam jadual berkala. Paling penting, ia membantu menggambarkan keupayaan elemen untuk membentuk molekul dan sebatian koordinasi yang lain, dan dengan itu, membantu mengenal pasti formula empirikal mereka.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah nombor pengoksidaan
3. Apa itu caj
4. Perbandingan sampingan - Nombor pengoksidaan vs caj dalam bentuk jadual
5. Ringkasan
Apakah nombor pengoksidaan?
Nombor pengoksidaan adalah ciri atom pusat sebatian koordinasi. Ini adalah pertuduhan atom pusat sebatian koordinasi apabila semua ikatan di sekeliling atom ini adalah ikatan ionik. Oleh itu, kadang -kadang caj dan nombor pengoksidaan adalah serupa, tetapi kadang -kadang berbeza. Contohnya, blok S mudah dan elemen blok p mempunyai nombor pengoksidaan yang sama sebagai caj mereka. Juga, ion polyatomik mempunyai nombor pengoksidaan yang sama seperti caj. Walau bagaimanapun, elemen kimia yang sama boleh mempunyai nombor pengoksidaan yang berbeza, bergantung pada atom lain di sekelilingnya. Dalam elemen percuma, nombor pengoksidaan selalu sifar. Tambahan pula, ion logam peralihan (blok D) dan unsur -unsur mempunyai bilangan pengoksidaan yang berbeza.
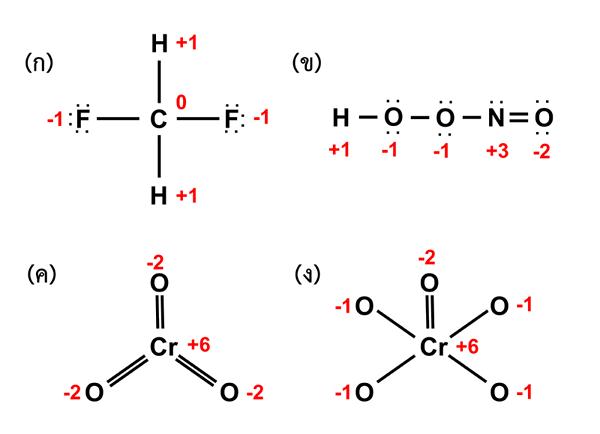
Rajah 01: Penentuan Bilangan Pengoksidaan Unsur yang Berbeza dalam Sebatian
Apabila mempertimbangkan sebatian koordinasi, atom logam pusat harus selalu mempunyai orbital kosong yang mana ligan menyumbangkan pasangan elektron tunggal mereka dan membentuk ikatan ionik. Selain itu, kita boleh menandakan nombor pengoksidaan atom logam tengah dengan nombor Rom di dalam kurungan. Sebagai contoh, jika bilangan pengoksidaan logam "m" adalah 3, maka kita menulisnya sebagai m (iii).
Apa itu caj?
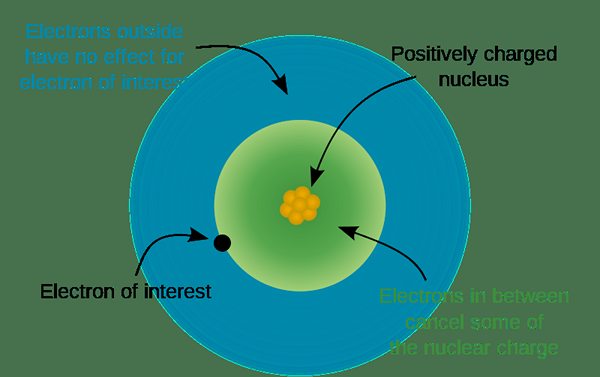
Caj sebarang atom adalah sifar. Apabila atom mengeluarkan atau mendapatkan elektron, mereka memperoleh cas elektrik. Itu kerana, elektron zarah subatomik yang dikenakan secara negatif sementara proton dikenakan secara positif. Atom melakukan penyingkiran atau mendapatkan elektron untuk mengisi shell valensi mereka mengikut peraturan oktet.
Dalam atom, bilangan proton dan elektron adalah sama. Oleh kerana proton mempunyai caj positif dan elektron mempunyai caj negatif, apabila elektron dari shell valensi mengeluarkan, atom membentuk ion yang positif, kerana kemudian bilangan proton positif lebih tinggi daripada bilangan elektron dalam ion tersebut.
Penentuan Caj
Selain itu, apabila atom lebih elektronegatif, ia dapat menarik elektron dari atom lain ke arah dirinya. Di sana, mereka mendapat lebih banyak elektron daripada bilangan proton yang tinggal di nukleus mereka. Oleh itu, atom menjadi ion negatif. Selanjutnya, bilangan elektron yang disumbangkan atau abstrak berbeza dari atom ke atom. Kita dapat meramalkan ini dari kedudukan elemen dalam jadual berkala. Biasanya, atom kumpulan yang sama akan membentuk ion yang sama, kerana mereka mempunyai bilangan elektron valensi yang sama.

Rajah 02: Struktur atom dalam menentukan caj
Nombor kumpulan juga menunjukkan bilangan elektron valensi; Oleh itu, kita dapat menentukan caj ion yang dibentuk oleh atom dalam kumpulan itu. Sebagai contoh, kumpulan satu elemen membentuk ion monovalen dengan +1 caj elektrik. Kumpulan dua elemen membentuk divalen ion positif. Kumpulan tiga dan kumpulan empat atom membentuk +3 dan +4 ion yang dikenakan. Dari kumpulan lima hingga kumpulan tujuh, atom membuat ion yang dikenakan negatif, kerana lebih mudah untuk mengisi elektron valensi mereka dengan hanya mendapat 2 atau 3 elektron daripada memancarkan lima, enam atau tujuh elektron. Oleh itu, kumpulan lima elemen membuat -3 ion dicas, manakala kumpulan 6 elemen membuat -2 ion dan kumpulan 7 elemen membuat -1 ion. Selain daripada ion yang hanya dikenakan, terdapat juga ion kompleks dengan caj seperti NH4+ dan co32-dan lain-lain.
Apakah perbezaan antara nombor pengoksidaan dan caj?
Nombor dan caj pengoksidaan adalah dua istilah yang berkaitan dalam kimia. Walau bagaimanapun, terdapat beberapa perbezaan antara nombor pengoksidaan dan caj. Perbezaan utama antara bilangan pengoksidaan dan caj ialah kita dapat menentukan bilangan pengoksidaan atom memandangkan bilangan elektron yang sama ada dikeluarkan atau diperolehi oleh atom itu sedangkan caj ditentukan memandangkan jumlah elektron dan proton dalam atom.
Tambahan pula, terdapat beberapa nombor pengoksidaan untuk elemen kimia yang sama bergantung kepada atom -atom di sekelilingnya sementara caj atom hanya berubah -ubah bergantung kepada bilangan elektron dan proton dalam atom. Oleh itu, ini adalah satu lagi perbezaan penting antara nombor pengoksidaan dan caj.

Ringkasan -Nombor pengoksidaan vs caj
Nombor caj dan pengoksidaan adalah dua syarat yang berkaitan. Perbezaan utama antara bilangan pengoksidaan dan caj ialah kita dapat menentukan bilangan pengoksidaan atom memandangkan bilangan elektron yang sama ada dikeluarkan atau diperolehi oleh atom itu sedangkan caj ditentukan memandangkan jumlah elektron dan proton dalam atom.
Rujukan:
1. "Nombor pengoksidaan."Logam peralihan. Terdapat di sini
2. Libretexts. "Atom."Kimia Libretexts, Yayasan Sains Kebangsaan, 26 Nov. 2018. Terdapat di sini
Ihsan gambar:
1."Tugasan Negeri Pengoksidaan" oleh Saranphong Yimklan - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2."Caj Nuklear Berkesan" oleh Kerja Sendiri - Caj Nuklear Berkesan.gif, (domain awam) melalui Wikimedia Commons


