Perbezaan antara pengoksidaan dan pengurangan
The Perbezaan utama antara pengoksidaan dan pengurangan ialah pengoksidaan merujuk kepada kehilangan elektron sementara pengurangan merujuk kepada keuntungan elektron.
Reaksi kimia antara sebatian yang berbeza dipanggil reaksi redoks jika keadaan pengoksidaan reaktan berbeza daripada produk. Redoks pendek untuk pengurangan-pengoksidaan, yang berlaku dalam sebarang reaksi kimia. Walaupun pengoksidaan merujuk kepada kehilangan elektron, pengurangan adalah di mana dapat diperoleh elektron. Reaksi ini boleh menjadi mudah atau kompleks, bergantung kepada proses dan atom yang terlibat.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu pengoksidaan
3. Apa itu pengurangan
4. Perbandingan sampingan - Pengoksidaan vs pengurangan dalam bentuk jadual
5. Ringkasan
Apa itu pengoksidaan?
Pengoksidaan boleh digambarkan sebagai peningkatan bilangan pengoksidaan. Oleh itu, pengoksidaan dapat ditakrifkan sebagai kehilangan elektron dari atom, molekul atau ion. Kehilangan elektron ini menyebabkan keadaan pengoksidaan spesies kimia ditingkatkan. Oleh kerana tindak balas pengoksidaan mengeluarkan elektron, harus ada spesies yang diterima elektron. Oleh itu, tindak balas pengoksidaan adalah tindak balas separuh reaksi utama. Pengoksidaan spesies kimia diberikan sebagai perubahan keadaan pengoksidaannya. Keadaan pengoksidaan adalah nombor dengan simbol positif (+) atau negatif (-), yang menunjukkan kehilangan atau keuntungan elektron oleh atom, molekul atau ion tertentu.

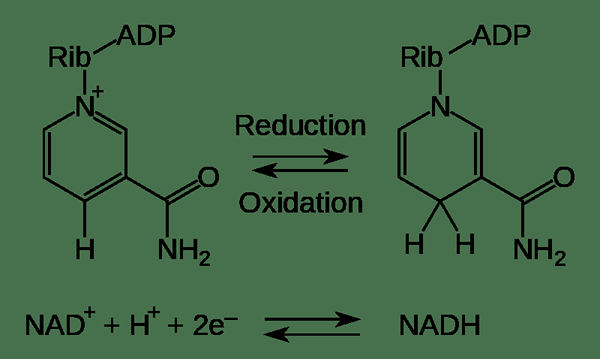
Rajah 01: Contoh dua reaksi separuh: pengoksidaan dan pengurangan
Pada masa lalu, istilah pengoksidaan diberikan definisi "penambahan oksigen ke sebatian."Ini kerana oksigen adalah satu -satunya ejen pengoksidaan yang diketahui pada masa itu. Walau bagaimanapun, definisi ini tidak lagi tepat kerana terdapat banyak lagi tindak balas pengoksidaan yang berlaku tanpa ketiadaan oksigen. Sebagai contoh, tindak balas antara magnesium (mg) dan asid hidroklorik (HCl) tidak melibatkan oksigen, tetapi ia adalah tindak balas redoks yang termasuk pengoksidaan Mg ke Mg2+.
Apa itu pengurangan?
Pengurangan boleh digambarkan sebagai penurunan nombor pengoksidaan. Oleh itu, kita dapat menentukan pengurangan sebagai keuntungan elektron dari atom, molekul, atau ion. Keuntungan elektron ini menyebabkan keadaan pengoksidaan spesies kimia menurun. Oleh kerana tindak balas pengurangan memperoleh elektron, harus ada spesies yang membatalkan elektron. Oleh itu, tindak balas pengurangan adalah tindak balas separuh reaksi utama. Pengurangan spesies kimia diberikan sebagai perubahan keadaan pengoksidaannya.
Pada masa lalu, pengurangan istilah diberikan definisi "Penyingkiran oksigen dari sebatian."Ini kerana oksigen adalah satu -satunya ejen pengoksidaan yang diketahui pada masa itu. Walau bagaimanapun, definisi ini tidak lagi tepat kerana terdapat banyak lagi tindak balas pengoksidaan yang berlaku tanpa ketiadaan oksigen.
Apakah perbezaan antara pengoksidaan dan pengurangan?
Pengurangan dan pengoksidaan adalah proses kimia yang terlibat dalam setiap tindak balas kimia. Ini adalah dua tindak balas yang bertentangan. Perbezaan utama antara pengoksidaan dan pengurangan adalah bahawa pengoksidaan merujuk kepada kehilangan elektron sementara pengurangan merujuk kepada keuntungan elektron. Walaupun pengoksidaan meningkatkan nilai tanda positif (+), pengurangan meningkatkan nilai tanda negatif (-).
Ringkasan -Pengoksidaan vs pengurangan
Pengurangan dan pengoksidaan adalah proses kimia yang terlibat dalam setiap tindak balas kimia. Perbezaan utama antara pengoksidaan dan pengurangan adalah bahawa pengoksidaan merujuk kepada kehilangan elektron sementara pengurangan merujuk kepada keuntungan elektron.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi pengoksidaan dan contoh dalam kimia."Thoughtco, Feb. 12, 2020, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Definisi pengurangan dalam kimia."Thoughtco, Feb. 11, 2020, boleh didapati di sini.
Ihsan gambar:
1. "Pengurangan Pengoksidaan NAD" oleh Fvasconcellos 19:44, 9 Disember 2007 (UTC). W: Imej: pengurangan pengoksidaan NAD.PNG oleh Tim Vickers. - Versi Vektor W: Imej: Pengurangan Pengoksidaan NAD.PNG oleh Tim Vickers (Domain Awam) melalui Commons Wikimedia


