Perbezaan antara n2 dan 2n
The Perbezaan utama antara n2 dan 2n ialah N2 adalah gas nitrogen atau nitrogen molekul, sedangkan 2N hanya merujuk kepada dua atom nitrogen.
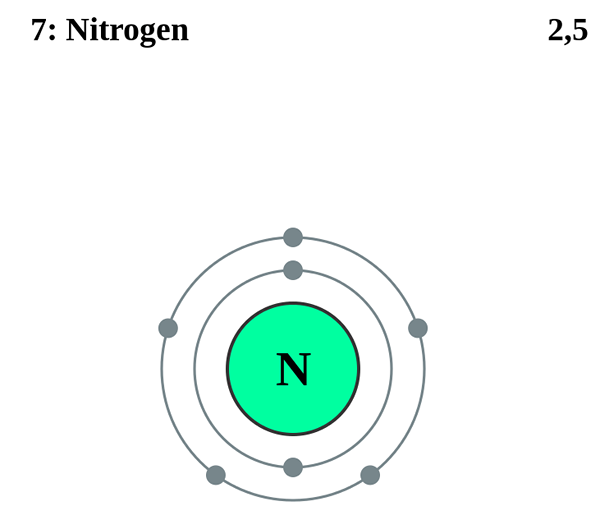
Nitrogen adalah elemen kimia, dan kita dapat menemuinya dalam kumpulan 15 dan tempoh 2 dari jadual berkala unsur kimia. Ia berlaku seperti gas nitrogen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu N2
3. Apa itu 2n
4. Perbandingan sampingan - N2 vs 2n dalam bentuk jadual
5. Ringkasan
Apa itu N2?
N2 adalah gas nitrogen molekul atau nitrogen. Ia adalah molekul diatomik yang mempunyai ikatan tiga kali ganda yang sangat kuat dalam nitrogen elemen. Ia adalah ikatan kedua terkuat dalam mana -mana molekul diatom, kedua hanya untuk ikatan dalam karbon monoksida. Oleh itu, sangat sukar untuk menukar N2 menjadi sebatian nitrogen yang berguna untuk kedua -dua organisma dan industri. Pada masa yang sama, pembakaran, meletup atau penguraian ikatan triple ini dalam molekul nitrogen mengeluarkan sejumlah besar tenaga berguna.

Umumnya, gas nitrogen tidak berwarna, tidak berbau dan tidak enak. Ia adalah gas diamagnet dan boleh mencairkan pada suhu yang sangat rendah (kira -kira -210 ijazah Celsius). Molekul N2 tidak aktif pada suhu bilik, tetapi ia boleh bertindak balas dengan logam litium dan beberapa kompleks logam peralihan lain. Tambahan pula, N2 boleh mencairkan pada suhu kira -kira 77 k dan boleh membekukan pada 63 k. Pembekuan ini membentuk bentuk allotropik kristal yang dibungkus heksagon.
Apa itu 2n?
2n hanya merujuk kepada dua atom nitrogen. Apabila dua atom nitrogen menggabungkan antara satu sama lain, ia menghasilkan molekul nitrogen diatomik, yang merupakan bentuk gas nitrogen yang semulajadi. Atom nitrogen mempunyai tujuh elektron dalam konfigurasi elektronik 1s22s22p3. Oleh itu, terdapat lima elektron valensi dalam satu atom nitrogen (dalam orbital 2s dan 2p). Di antara lima elektron valensi ini, tiga tidak berpasangan dan dua yang lain dipasangkan antara satu sama lain.
Selain itu, atom nitrogen mempunyai salah satu nilai elektronegativiti tertinggi di antara unsur -unsur kimia (nilai hanya melebihi nilai elektronegativiti klorin, oksigen dan fluorin). Oleh kerana angka yang tinggi ini, nitrogen biasanya tidak mempunyai kimia kationik. Biasanya, atom nitrogen adalah serupa dengan atom oksigen kerana elektronegativiti tinggi dan keupayaan bersamaan untuk ikatan hidrogen. Di samping itu, ia mempunyai keupayaan untuk membentuk kompleks koordinasi yang serupa dengan oksigen melalui mendermakan pasangan tunggal elektron.
Tambahan pula, istilah 2N boleh merujuk kepada mana-mana isotop nitrogen yang stabil kerana terdapat dua isotop stabil nitrogen, termasuk N-14 dan N-15. Antaranya, isotop yang paling biasa adalah n-14, yang membentuk kira-kira 99% kandungan nitrogen semula jadi.
Di samping itu, atom 2n atau dua nitrogen boleh dinamakan nitrogen aktif kerana kereaktifan yang tinggi, dan atom nitrogen bebas adalah tri-radikal dengan tiga elektron yang tidak berpasangan. Oleh itu, atom nitrogen bebas ini dengan mudah boleh bertindak balas dengan unsur -unsur kimia lain untuk membentuk nitrida, dan apabila dua atom nitrogen bertindak balas antara satu sama lain untuk membentuk molekul N2 yang teruja, tindak balas itu mengeluarkan banyak tenaga.
Apakah perbezaan antara N2 dan 2N?
N2 dan 2N adalah dua bentuk elemen kimia nitrogen. Perbezaan utama antara N2 dan 2N ialah N2 adalah nitrogen molekul atau gas nitrogen, sedangkan 2n hanya merujuk kepada dua atom nitrogen. Oleh itu, N2 adalah molekul gas diatomik manakala 2N adalah atom nitrogen percuma. Selain itu, N2 kebanyakannya tidak aktif manakala 2N sangat reaktif.
Berikut adalah ringkasan perbezaan antara N2 dan 2n dalam bentuk jadual.

Ringkasan -N2 vs 2N
Nitrogen adalah elemen kimia yang penting. Perbezaan utama antara N2 dan 2N ialah N2 adalah nitrogen molekul atau gas nitrogen manakala 2N hanya merujuk kepada dua atom nitrogen.
Rujukan:
1. "Nitrogen." Wikipedia, Yayasan Wikimedia, 23 Feb. 2021, boleh didapati di sini.
Ihsan gambar:
1. "Elektron Shell 007 Nitrogen" oleh Pumbaa (karya asal oleh Greg Robson) - Fail: Electron Shell 007 Nitrogen.PNG, (CC BY-SA 2.0 uk) melalui Commons Wikimedia


