Perbezaan antara monoksida dan dioksida
Perbezaan utama - monoksida vs dioksida
Istilah monoksida dan dioksida digunakan dalam tatanama sebatian oksida. Oksida adalah sebatian kimia yang mengandungi sekurang -kurangnya satu atom oksigen yang terikat dengan elemen lain. Kadang -kadang istilah oksida digunakan untuk menamakan anion oksida (o2-). Sebilangan besar elemen dapat dijumpai secara semula jadi dalam bentuk kompaun oksida mereka. Beberapa elemen membentuk sebatian oksida yang berbeza berdasarkan keadaan pengoksidaan mereka. Istilah monoksida digunakan untuk menamakan sebatian yang mempunyai satu atom oksigen yang terikat dengan elemen lain. Oleh itu, istilah dioksida menyatakan kehadiran dua atom oksigen. Beberapa elemen membentuk oksida dengan lebih daripada dua atom oksigen. The Perbezaan utama antara monoksida dan dioksida ialah Sebatian monoksida mengandungi satu atom oksigen yang terikat kepada elemen lain manakala sebatian dioksida mengandungi dua atom oksigen yang terikat kepada atom yang sama dari elemen yang berbeza.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu monoksida
3. Apa itu dioksida
4. Perbandingan sampingan - monoksida vs dioksida dalam bentuk jadual
5. Ringkasan
Apa itu monoksida?
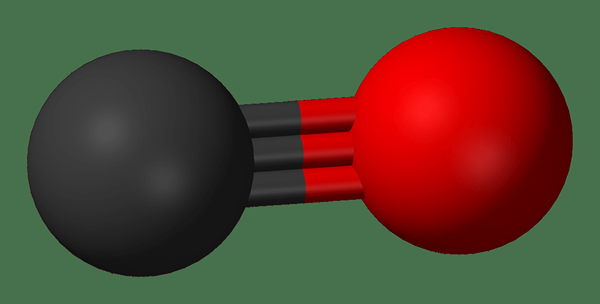
Istilah monoksida digunakan untuk menamakan sebatian yang mengandungi satu atom oksigen yang terikat dengan elemen lain. Apabila mempertimbangkan anion, istilah monoksida merujuk kepada anion oksida (o2-). Walau bagaimanapun, dalam sebatian monoksida, satu -satunya atom oksigen boleh terikat kepada satu atom elemen lain atau dua atom itu, tetapi tidak lebih daripada dua. Itu kerana atom oksigen hanya dapat membentuk dua ikatan kovalen dalam keadaan stabilnya.
Kumpulan 1 elemen jadual berkala hanya boleh mempunyai keadaan pengoksidaan +1. Tetapi anion oksida mempunyai -2 keadaan pengoksidaan. Kemudian, elemen monoksida kumpulan 1 mempunyai dua atom yang terikat dengan atom oksigen yang sama. Tetapi dalam hal elemen Kumpulan 2, keadaan pengoksidaan stabil mereka adalah +2. Kemudian, satu atom oksigen mengikat kepada satu atom (elemen kumpulan 2) untuk membentuk monoksida.

Rajah 01: Monoksida mempunyai satu atom oksigen (merah) yang terikat dengan elemen lain.
Terdapat pelbagai sebatian monoksida. Beberapa contoh diberikan di bawah.

Apa itu dioksida?
Istilah dioksida digunakan untuk menamakan sebatian yang mengandungi dua atom oksigen yang terikat dengan elemen yang berbeza. Sebatian ini pada dasarnya terdiri daripada dua atom oksigen. Kebanyakan masa kedua -dua atom oksigen ini terikat dengan atom yang sama (dari unsur kimia yang berbeza).
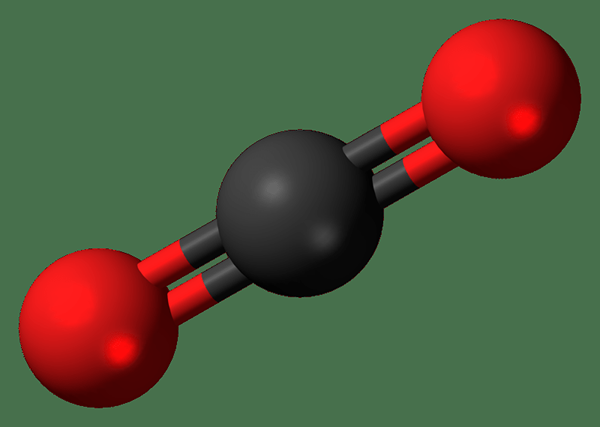
Rajah 02: Dioksida mempunyai dua atom oksigen (dalam warna merah).
Terdapat pelbagai sebatian dioksida. Beberapa contoh diberikan di bawah.
- Karbon dioksida (CO2)
- Nitrogen dioksida (tidak2)
- Sulfur dioksida (begitu2)
- Barium dioksida (Bao2)
- Silikon dioksida (SIO2)
Walaupun h2O2 juga terdiri daripada dua atom oksigen, ia tidak dianggap sebagai dioksida. Ia dikenali sebagai hidrogen peroksida. Sebabnya, untuk memanggil oksida yang mengandungi dua atom oksigen, dioksida, keadaan pengoksidaan atom oksigen dalam sebatian itu harus berada dalam keadaan stabilnya (-2 keadaan pengoksidaan). Dalam h2O2, Oksigen berada dalam keadaan pengoksidaan -1, oleh itu, ia dikenali sebagai peroksida.
Apakah perbezaan antara monoksida dan dioksida?
Monoxide vs dioksida | |
| Istilah monoksida digunakan untuk menamakan sebatian yang mengandungi satu atom oksigen yang terikat dengan elemen lain. | Istilah dioksida digunakan untuk menamakan sebatian yang mengandungi dua atom oksigen yang terikat dengan elemen yang berbeza. |
| Atom oksigen | |
| Monoksida mempunyai satu atom oksigen. | Dioksida mempunyai dua atom oksigen. |
Ringkasan -Monoxide vs dioksida
Monoksida dan dioksida adalah istilah yang digunakan untuk menamakan oksida yang berbeza berdasarkan atom oksigen yang terdapat dalam struktur kimia mereka. Perbezaan antara monoksida dan dioksida ialah sebatian monoksida mengandungi satu atom oksigen yang terikat kepada elemen lain manakala sebatian dioksida mengandungi dua atom oksigen yang terikat kepada atom yang sama dengan elemen yang berbeza.
Muat turun pdf monoksida vs dioksida
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi PDF di sini: Perbezaan antara monoksida dan dioksida
Rujukan:
1."Monoxide."Wikipedia, Yayasan Wikimedia, 31 dec. 2017. Terdapat di sini
2."Kimia GCSE - Oksigen dan Oksida - Semakan 5."BBC Bitesize, BBC. Terdapat di sini
Ihsan gambar:
1.'Carbon-Monoxide-3D-Balls'by Benjah-Bmm27-Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2.'Karbon Dioksida 3d Ball'by Jynto - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


