Perbezaan antara monatomik dan polyatomik
Monatomik vs polyatomik
Bilangan atom yang terdapat dalam ion tertentu atau molekul adalah apa yang menyumbang kepada perbezaan antara monatomi dan polyatomik. Dua perkataan "mono" dan "poli" memberikan idea umum mengenai molekul; "Mono" bermaksud "bujang" dan "poli" bermaksud "banyak."Monatomi merujuk kepada ion atau molekul yang mempunyai satu atom. Polatomik merujuk kepada molekul atau ion yang mempunyai dua atau lebih atom. Terdapat begitu banyak perbezaan fizikal dan kimia antara monatomi dan polyatomik kerana perbezaan bilangan atom. Secara amnya unsur -unsur kimia monatomi kurang banyak berbanding dengan kewujudan molekul polyatomik.
Apa itu monatomi?
Perkataan monatomi berasal dari dua perkataan "mono" dan "atom," yang memberikan makna "atom tunggal."Spesies kimia monatomi hanya mengandungi satu atom dan mereka stabil walaupun mereka wujud sendiri. Ini boleh digunakan untuk gas dan ion. Sebilangan besar gas mulia wujud sebagai spesies kimia monatomi.
Ion monatomi: Ion ini dibentuk dengan kehilangan (ion positif) atau memperoleh (ion negatif) elektron.
Ion positif: Na+, K+, CA2+, AL3+
Ion negatif: Cl-, S2-, Br-, F-
Molekul Monatomi: Gas mulia jatuh ke dalam kategori ini dan mereka sangat stabil; Oleh itu, tidak aktif secara kimia.

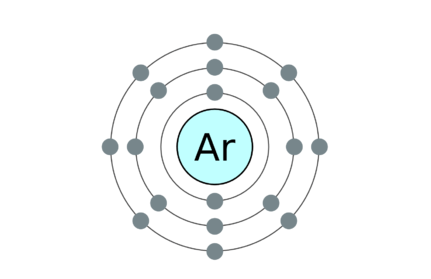
18: Argon 2, 8, 8
Apa itu polyatomik?
Kata polyatomik berasal dari dua perkataan "poli" dan "atom," bermaksud banyak atom. Ia boleh menjadi atom homogen (o2, Hg22+, O3, O22-) atau gabungan atom heterogen (CN-, H2Jadi4, Clo3-). Sebilangan besar molekul dan ion wujud sebagai sifat polyatomik.
Ion polyatomik: "Ion Molekul" adalah nama lain untuk ion polyatomik. Sebilangan besar ion polyatomik sama ada spesies kimia kovalen atau kompleks logam.
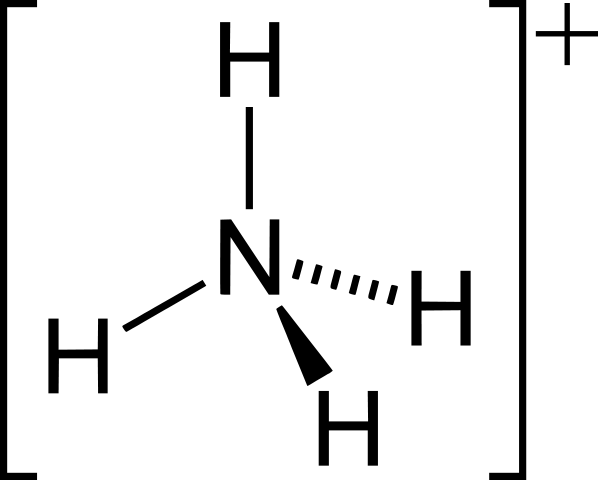
Ion positif: NH4+, H3O+, Ph4+
Ion negatif: Cro42-, Co32-, Ch3COO-, Jadi42-, Tidak3-
Molekul Polatomik: Mereka adalah molekul dengan dua atau lebih atom. Mereka tidak mempunyai caj positif atau negatif. Dalam erti kata lain, molekul ini secara elektrik berkecuali. (H2Jadi4, Ch3COOH, NA2Co3, NaCl, c2H4)
Ammonium
Apakah perbezaan antara monatomi dan polyatomik?
• Bilangan atom:
• Unsur kimia monatomi mengandungi Hanya satu atom.
• Sebatian kimia polyatomik mempunyai dua atau lebih atom.
• Nyatakan:
• Spesies kimia monatomi boleh menjadi ion atau gas lengai.
• Beberapa spesies polyatomik adalah ion dan ada yang molekul.
• Hartanah
• Sebilangan besar ion monatomi stabil di dalam air.
• Molekul monatomi sangat stabil; Oleh itu, tidak aktif secara kimia.
• Sebilangan besar ion polyatomik sama ada kompleks terikat kovalen atau logam.
• Molekul polyatomik secara elektrik berkecuali.
• Contoh untuk monatomi dan polyatomik:
• Contoh untuk ion monatomi adalah na+, Ca2+, K+, Al3+ dan Fe3+.
• Contoh untuk molekul monatomi adalah gas mulia. Mereka adalah helium (dia), neon (ne), argon (ar), krypton (kr), xenon (xe) dan radon (ra).
• Contoh untuk ion polyatomik adalah CRO42-, Co32-, NH4+, H3O+.
• Contoh untuk molekul polyatomik Adakah KCl, KBRO3, C6H5COOH.
• Saiz:
• Saiz spesies kimia monatomi berbeza mengikut cara mereka membentuk. Sebagai contoh, apabila ion positif dibentuk saiz mereka berkurangan dan apabila ion negatif terbentuk, saiz meningkat daripada atom asal. Gas mulia mempunyai saiz terkecil berbanding dengan unsur -unsur lain dalam tempoh mereka dalam jadual berkala.
• Apabila sebatian kimia polyatomik terbentuk, saiz ion polyatomik atau molekul polyatom menjadi lebih besar daripada semua atom asal di dalam kompaun. Kerana, dua atau lebih atom bergabung untuk membentuk ion /molekul polyatomik.
• Bentuk:
• Molekul dan ion monatomi secara amnya adalah sfera dalam geometri mereka.
• Geometri spesies kimia polyatomik berbeza -beza bergantung kepada bilangan molekul dan pasangan tunggal yang terdapat dalam molekul. Oleh kerana bilangan atom meningkatkan struktur yang lebih kompleks terbentuk untuk mencapai kestabilan.
Gambar ihsan:
- Argon oleh Greg Robson (CC BY-SA 2.0 UK)
- Ammonium melalui Wikicommons (domain awam)


