Perbezaan antara elektrolisis cair dan berair
The Perbezaan utama Antara elektrolisis cair dan berair ialah elektrolisis cair menghasilkan unsur -unsur analit, sedangkan elektrolisis berair menghasilkan larutan garam berair dan campuran gas sebagai produk akhir.
Elektrolisis cair dan berair adalah dua jenis kaedah elektrolisis dalam kimia analisis yang berbeza antara satu sama lain mengikut sifat medium elektrolitik. Istilah "cair" merujuk kepada keadaan cecair analit dalam ketiadaan air sementara istilah "berair" merujuk kepada keadaan cecair dengan kehadiran air.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah elektrolisis cair
3. Apakah elektrolisis berair
4. Perbandingan sampingan - cair vs elektrolisis berair dalam bentuk tabular
5. Ringkasan
Apakah elektrolisis cair?
Elektrolisis cair adalah teknik dalam kimia analisis yang menggunakan arus elektrik untuk memisahkan elemen kimia dalam bahan analit dalam keadaan cairnya. Umumnya, sebatian ionik digunakan dalam kaedah elektrolisis ini. Teknik ini memberikan maklumat tentang bagaimana kita dapat mengekstrak logam seperti aluminium dan natrium dari sebatian ionik cair mereka menggunakan arus elektrik.
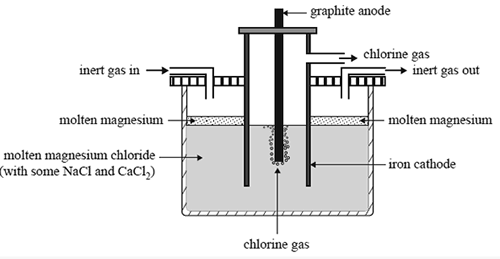
Rajah 01: Pengekstrakan logam magnesium
Sebagai contoh, aluminium adalah logam yang paling banyak di permukaan bumi, tetapi ia tidak berlaku dalam keadaan murni. Sebaliknya, ia berlaku sebagai sebatian ionik di mineral. Oleh itu, kita perlu memisahkan aluminium dari sebatiannya melalui elektrolisis. Di sini, kami menggunakan sebatian ionik cair. Bentuk sebatian ionik disebabkan oleh pembentukan ikatan ionik yang kuat yang wujud di antara kation dan anion. Dalam keadaan pepejal sebatian ionik, anion dan kation terkunci dalam struktur tegar sehingga mereka tidak dapat menjalankan elektrik. Oleh itu, kita tidak boleh menggunakan sebatian pepejal untuk elektrolisis. Tetapi dalam keadaan cairnya, sebatian ionik memisahkan ke dalam anion dan kation, yang membolehkan keadaan cair analit untuk menjalankan elektrik. Kita boleh mendapatkan keadaan lebur melalui mencairkan pepejal. Oleh itu, kita boleh menamakan keadaan cair analit sebagai elektrolit.
Semasa proses elektrolisis cair, kation bergerak ke arah elektrod negatif sementara anion bergerak ke arah elektrod positif. Pada elektrod negatif (katod), kation mendapat elektron dan menjadi atom. Pada elektrod positif atau anod, ion kehilangan elektron menjadi atom.
Apakah elektrolisis berair?
Elektrolisis berair adalah teknik dalam kimia analisis yang menggunakan arus elektrik untuk memisahkan unsur -unsur kimia dalam bahan analit dalam keadaan berairnya. Jenis elektrolisis ini penting dalam mendapatkan bahan atau gas tertentu. Sebagai contoh, jika kita lulus arus elektrik melalui air, ia membentuk gas hidrogen dan gas oksigen.

Rajah 02: Elektrolisis air
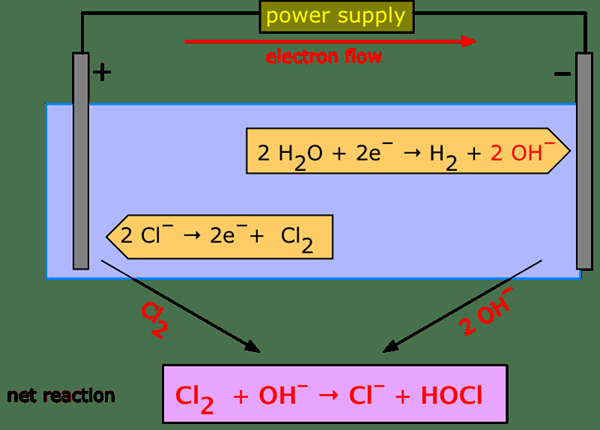
Dalam proses elektrolisis berair, arus elektrik diluluskan melalui elektrolit terionisasi; Di sini kation bergerak ke arah anod dan anion bergerak ke arah katod. Sistem jenis ini dipanggil sel elektrolitik. Terdapat banyak aplikasi elektrolisis berair, termasuk elektroplating, penapisan bauksit ke dalam aluminium, menghasilkan soda klorin dan kaustik dari garam meja, dan lain -lain.
Apakah perbezaan antara elektrolisis cair dan berair?
Elektrolisis cair dan berair adalah teknik analisis dalam kimia yang berguna dalam memisahkan unsur -unsur kimia dalam bahan analit. Perbezaan utama antara elektrolisis cair dan berair ialah elektrolisis cair menghasilkan unsur -unsur analit, sedangkan elektrolisis berair menghasilkan larutan garam berair dan campuran gas sebagai produk akhir.
Di bawah infographic menunjukkan lebih banyak perbandingan yang berkaitan dengan perbezaan antara elektrolisis cair dan berair.
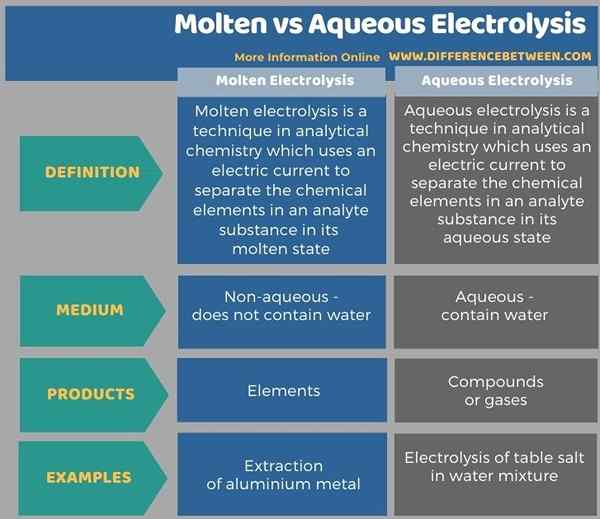
Ringkasan -Elektrolisis berair cair vs
Elektrolisis adalah teknik dalam kimia analisis yang merangkumi penggunaan elektrik untuk memisahkan unsur -unsur dalam bahan. Elektrolisis cair dan berair adalah dua jenis elektrolisis. Perbezaan utama antara elektrolisis cair dan berair ialah elektrolisis cair menghasilkan unsur -unsur analit, sedangkan elektrolisis berair menghasilkan larutan garam berair dan campuran gas sebagai produk akhir.
Rujukan:
1. "Elektrolisis sebatian cair."Kajian.com, boleh didapati di sini.
Ihsan gambar:
1. "Mg oleh Elektrolisis" oleh Raveendra R.S. - Kerja Sendiri (CC BY-SA 4.0) melalui Commons Wikimedia
2. "NaCl Electrolysis Air" oleh kerja yang lebih perlahan (CC BY -SA 3.0) melalui Commons Wikimedia


