Perbezaan antara teori orbital molekul dan teori ikatan valensi
The Perbezaan utama Antara teori orbital molekul dan teori ikatan valensi ialah Teori orbital molekul menerangkan pembentukan orbital molekul, sedangkan teori ikatan valensi menggambarkan orbital atom.
Molekul yang berbeza mempunyai sifat kimia dan fizikal yang berbeza daripada atom individu yang bergabung untuk membentuk molekul ini. Untuk memahami perbezaan ini antara sifat atom dan molekul, perlu memahami pembentukan ikatan kimia antara beberapa atom untuk membuat molekul. Pada masa ini, kami menggunakan dua teori mekanikal kuantum untuk menggambarkan ikatan kovalen dan struktur elektronik molekul. Ini adalah teori ikatan valensi dan teori orbital molekul.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah teori orbital molekul
3. Apakah teori ikatan valensi
4. Perbandingan sampingan - Teori Orbital Molekul vs Teori Bond Valence dalam Bentuk Tabular
5. Ringkasan
Apakah teori orbital molekul?
Dalam molekul, elektron tinggal di orbital molekul, tetapi bentuknya berbeza, dan ia dikaitkan dengan lebih daripada satu nukleus atom. Teori orbital molekul adalah penerangan molekul berdasarkan orbital molekul.
Kita boleh mendapatkan fungsi gelombang yang menerangkan orbital molekul dengan kombinasi linear orbital atom. Bentuk orbital ikatan apabila dua orbital atom berinteraksi dalam fasa yang sama (interaksi konstruktif). Apabila mereka berinteraksi dari fasa (interaksi merosakkan), orbital anti-ikatan dari. Oleh itu, terdapat orbital ikatan dan anti-ikatan untuk setiap interaksi suborbital. Orbital ikatan mempunyai tenaga yang rendah, dan elektron lebih cenderung tinggal di dalamnya. Orbital anti-ikatan tinggi tenaga, dan apabila semua orbital ikatan diisi, elektron pergi dan mengisi orbital anti-ikatan.
Apakah teori ikatan valensi?
Teori ikatan valensi didasarkan pada pendekatan bon setempat, yang mengandaikan bahawa elektron dalam molekul menduduki orbital atom atom individu. Sebagai contoh, dalam pembentukan h2 molekul, dua atom hidrogen bertindih. Dengan bertindih dua orbital, mereka berkongsi kawasan yang sama di ruang angkasa. Pada mulanya, apabila kedua -dua atom itu jauh, tidak ada interaksi di antara mereka. Oleh itu, tenaga berpotensi adalah sifar.
Apabila atom saling menghampiri, setiap elektron tertarik oleh nukleus di atom yang lain, dan pada masa yang sama, elektron menangkis satu sama lain, seperti nukleus. Walaupun atom masih dipisahkan, tarikan lebih besar daripada penolakan, jadi tenaga potensi sistem berkurangan. Titik di mana tenaga berpotensi mencapai nilai minimum, sistem berada pada kestabilan. Inilah yang berlaku apabila dua atom hidrogen datang bersama dan membentuk molekul.

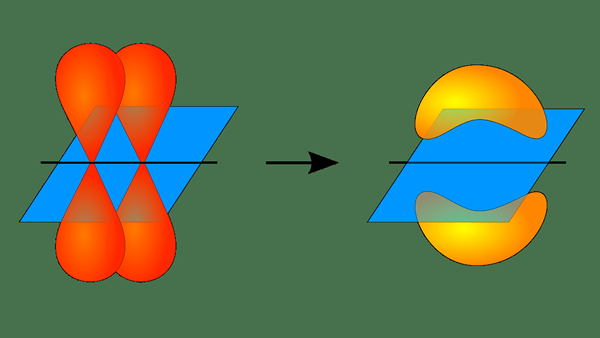
Rajah 01: Pembentukan ikatan Pi
Walau bagaimanapun, konsep bertindih ini hanya dapat menggambarkan molekul mudah seperti h2, F2, HF, dll. Teori ini gagal menerangkan molekul seperti CH4. Walau bagaimanapun, masalah ini dapat diselesaikan dengan menggabungkan teori ini dengan teori orbit hibrida. Hibridisasi adalah pencampuran dua orbital atom yang tidak seimbang. Contohnya, di Ch4, C mempunyai empat sp hibridisasi3 Orbital bertindih dengan orbital s setiap h.
Apakah perbezaan antara teori orbital molekul dan teori ikatan valensi?
Pada masa ini, kami menggunakan dua teori mekanikal kuantum untuk menggambarkan ikatan kovalen dan struktur elektronik molekul. Ini adalah teori ikatan valensi dan teori orbital molekul. Perbezaan utama antara teori orbital molekul dan teori ikatan valensi ialah teori orbital molekul menggambarkan pembentukan orbital molekul, sedangkan teori ikatan valensi menggambarkan orbital atom. Selain itu, teori ikatan valensi hanya boleh digunakan untuk molekul diatomik, dan bukan untuk molekul polyatomik. Walau bagaimanapun, kita boleh menggunakan teori orbital molekul untuk sebarang molekul.
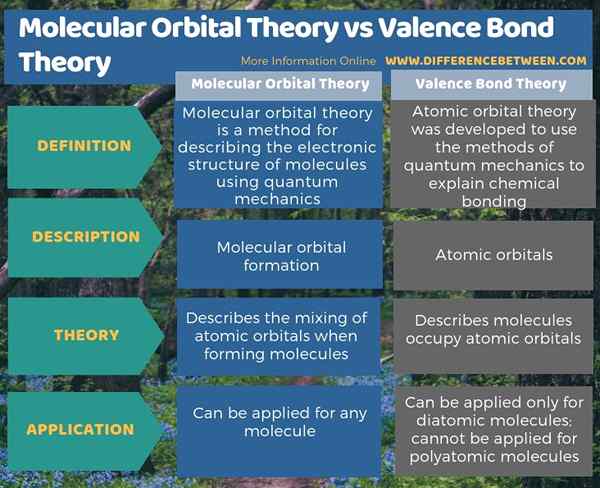
Ringkasan -Teori Orbital Molekul vs Teori Bond Valence
Teori ikatan valensi dan teori orbital molekul adalah dua teori mekanikal kuantum yang menggambarkan ikatan kovalen dan struktur elektronik molekul. Perbezaan utama antara teori orbital molekul dan teori ikatan valensi ialah teori orbital molekul menggambarkan pembentukan orbital molekul, sedangkan teori ikatan valensi menggambarkan orbital atom.
Rujukan:
1. Helmenstine, Anne Marie. "Bond Valence (VB) Definisi Teori."Thoughtco, Aug. 4, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Pi-Bond" oleh Pi-Bond.JPG: Jojanderivative Work: Vladsinger (Talk) - Pi -Bond.JPG (CC BY-SA 3.0) melalui Commons Wikimedia


