Perbezaan antara teori orbital molekul dan teori hibridisasi
The Perbezaan utama Antara teori orbital molekul dan teori hibridisasi ialah Teori orbital molekul menerangkan pembentukan orbital ikatan dan anti-ikatan, sedangkan teori hibridisasi menggambarkan pembentukan orbital hibrida.
Terdapat teori yang berbeza yang dibangunkan untuk menentukan struktur molekul elektronik dan orbit. Teori VSEPR, Teori Lewis, Teori Bond Valence, Teori Hibridisasi dan Teori Orbital Molekul adalah Teori Penting. Teori yang paling boleh diterima di antara mereka adalah teori orbit molekul.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah teori orbital molekul
3. Apakah teori hibridisasi
4. Perbandingan sampingan - Teori Orbital Molekul vs Teori Hibridisasi
5. Ringkasan
Apakah teori orbital molekul?
Teori Orbital Molekul adalah teknik menggambarkan struktur elektronik molekul menggunakan mekanik kuantum. Ini adalah cara paling produktif untuk menerangkan ikatan kimia dalam molekul. Mari kita bincangkan teori ini secara terperinci.
Pertama, kita perlu tahu apa orbital molekul. Ikatan kimia membentuk antara dua atom apabila daya tarikan bersih antara dua nukleus atom dan elektron di antara mereka melebihi penolakan elektrostatik antara dua nukleus atom. Pada asasnya, ini bermakna, daya menarik antara dua atom harus lebih tinggi daripada daya menjijikkan antara kedua -dua atom tersebut. Di sini, elektron mesti wujud di rantau yang dipanggil "rantau mengikat", untuk membentuk ikatan kimia ini. Jika tidak, elektron akan berada di "rantau anti-mengikat" yang akan membantu daya menjijikkan antara atom.
Walau bagaimanapun, jika keperluan dipenuhi dan bentuk ikatan kimia antara dua atom, maka orbital yang sama yang terlibat dalam ikatan dipanggil orbital molekul. Di sini, kita boleh bermula dengan dua orbital dua atom dan berakhir dengan satu orbital (orbital molekul) yang dimiliki oleh kedua -dua atom.
Menurut mekanik kuantum, orbital atom tidak dapat muncul atau hilang seperti yang kita kehendaki. Apabila orbital berinteraksi antara satu sama lain, mereka cenderung mengubah bentuk mereka dengan sewajarnya. Tetapi menurut mekanik kuantum, mereka bebas mengubah bentuk tetapi perlu mempunyai bilangan orbital yang sama. Kemudian kita perlu mencari orbital yang hilang. Di sini, gabungan fasa kedua-dua orbital atom menjadikan orbital ikatan manakala gabungan luar fasa membentuk orbital anti-ikatan.
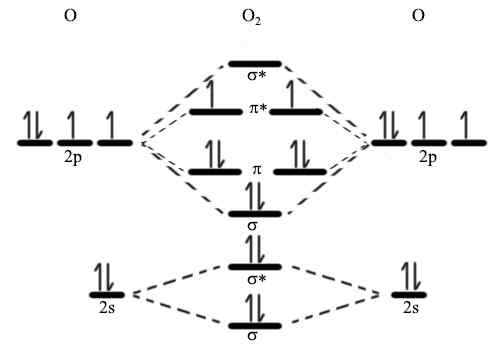
Rajah 01: Rajah orbital molekul
Elektron ikatan menduduki orbital ikatan sementara elektron di orbital anti-ikatan tidak mengambil bahagian dalam pembentukan bon. Sebaliknya, elektron ini secara aktif menentang pembentukan ikatan kimia. Orbital ikatan mempunyai tenaga berpotensi yang lebih rendah daripada orbital anti-ikatan. Jika kita menganggap ikatan sigma, denotasi untuk orbital ikatan adalah σ, dan orbital anti-ikatan adalah σ*. Kita boleh menggunakan teori ini untuk menggambarkan struktur molekul rumit untuk menjelaskan mengapa beberapa molekul tidak wujud (i.e. Dia2) dan susunan molekul bon. Oleh itu, penerangan ini secara ringkas menerangkan asas teori orbital molekul.
Apakah teori hibridisasi?
Teori hibridisasi adalah teknik yang kita gunakan untuk menggambarkan struktur orbit molekul. Hibridisasi adalah pembentukan orbital hibrid dengan mencampurkan dua atau lebih orbital atom. Orientasi orbital ini menentukan geometri molekul. Ini adalah pengembangan teori ikatan valensi.
Sebelum pembentukan orbital atom, mereka mempunyai tenaga yang berbeza, tetapi selepas pembentukan, semua orbital mempunyai tenaga yang sama. Sebagai contoh, orbital atom S, dan orbital atom P boleh bergabung untuk membentuk dua orbital SP. Orbital atom S dan P mempunyai tenaga yang berbeza (tenaga S < energy of p). But after the hybridization, it forms two sp orbitals which have the same energy, and this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

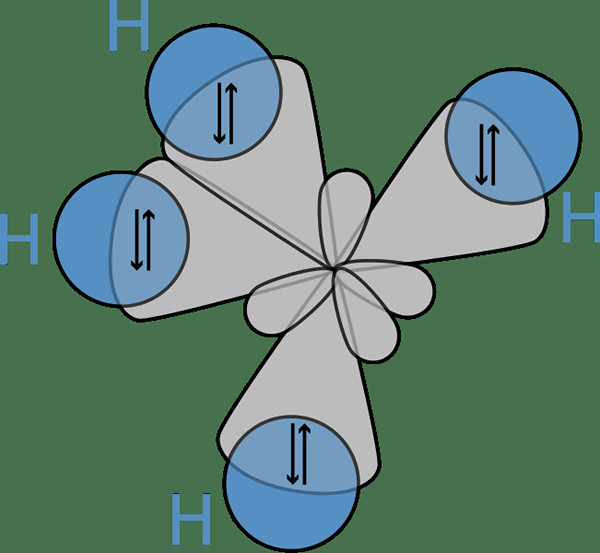
Rajah 02: Ikatan antara orbital hibrid atom karbon dan orbital s atom hidrogen
Idea hibridisasi mula -mula memasuki perbincangan kerana saintis memerhatikan bahawa teori ikatan valensi gagal meramalkan struktur beberapa molekul seperti ch4. Di sini, walaupun atom karbon hanya mempunyai dua elektron yang tidak berpasangan mengikut konfigurasi elektron, ia boleh membentuk empat ikatan kovalen. Untuk membentuk empat bon, mesti ada empat elektron yang tidak berpasangan.
Satu -satunya cara mereka dapat menjelaskan fenomena ini adalah untuk berfikir bahawa S dan P orbitals fius atom karbon antara satu sama lain untuk membentuk orbital baru yang dipanggil orbital hibrid yang mempunyai tenaga yang sama. Di sini, satu s + tiga p memberikan 4 sp3 orbital. Oleh itu, elektron mengisi orbital hibrid ini secara merata (satu elektron per orbital hibrid), mematuhi peraturan hund. Kemudian terdapat empat elektron untuk pembentukan empat ikatan kovalen dengan empat atom hidrogen.
Apakah perbezaan antara teori orbital molekul dan teori hibridisasi?
Teori orbital molekul adalah teknik menggambarkan struktur elektronik molekul menggunakan mekanik kuantum. Teori hibridisasi adalah teknik yang kita gunakan untuk menggambarkan struktur orbit molekul. Oleh itu, perbezaan utama antara teori orbital molekul dan teori hibridisasi ialah teori orbital molekul menggambarkan pembentukan orbital ikatan dan anti-ikatan, sedangkan teori hibridisasi menggambarkan pembentukan orbital hibrid.
Tambahan pula, menurut teori orbit molekul, bentuk orbital baru dari pencampuran orbital atom dua atom manakala dalam teori hibridisasi, bentuk orbital baru membentuk pencampuran orbital atom atom yang sama. Oleh itu, ini adalah satu lagi perbezaan antara teori orbital molekul dan teori hibridisasi.
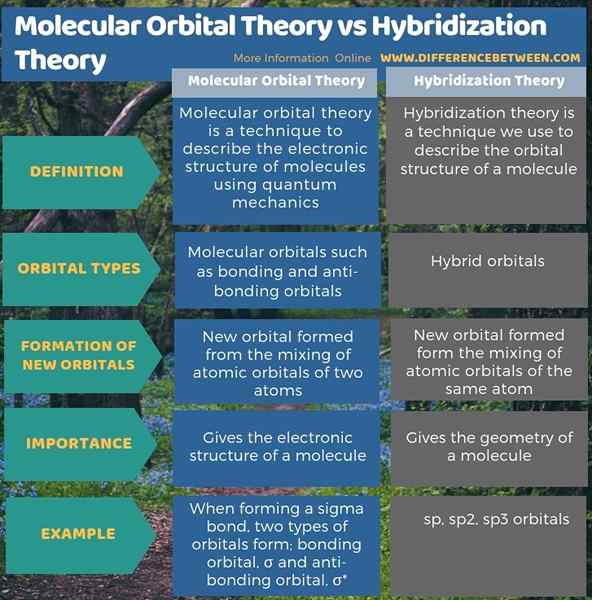
Ringkasan -Teori Orbital Molekul vs Teori Hibridisasi
Kedua -dua teori orbital molekul dan teori hibridisasi adalah penting dalam menentukan struktur molekul. Perbezaan utama antara teori orbital molekul dan teori hibridisasi ialah teori orbital molekul menggambarkan pembentukan orbital ikatan dan anti-ikatan, sedangkan teori hibridisasi menggambarkan pembentukan orbital hibrida.
Rujukan:
1. "Hibridisasi."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
Ihsan gambar:
1. "O2moleculardiagramcr" oleh Tcreuter - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Hibridisasi CH4" oleh k. Aainsqatsi di Wikipedia Bahasa Inggeris (teks asal: k. Aainsqatsi) - Kerja sendiri (teks asal: buatan sendiri) (domain awam) melalui Commons Wikimedia


