Perbezaan antara kelarutan molar dan pemalar kelarutan produk

The Perbezaan utama antara kelarutan molar dan pemalar kelarutan produk ialah Kelarutan Molar menerangkan pembubaran bahan seliter penyelesaian, sedangkan pemalar kelarutan produk menerangkan pembubaran bahan pepejal dalam larutan akueus.
Kedua -dua kelarutan molar dan kelarutan produk adalah konsep kimia yang menggambarkan pembubaran bahan dalam penyelesaian. Kita boleh mengira kelarutan molar dari pemalar kelarutan produk. Oleh itu, mereka saling berkaitan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah kelarutan molar
3. Apakah kelarutan produk yang berterusan
4. Perbandingan sampingan - Kelarutan molar dan kelarutan produk pemalar dalam bentuk jadual
5. Ringkasan
Apakah kelarutan molar?
Kelarutan Molar adalah bilangan tahi lalat bahan yang membubarkan seliter penyelesaian sebelum tepu. Maksudnya; Kelarutan molar memberikan jumlah bahan yang dapat kita larut dalam larutan sebelum penyelesaiannya menjadi tepu dari bahan tersebut. Kita boleh mengira jumlah ini menggunakan kelarutan produk pemalar atau KSP dan stoikiometri. Unit untuk kelarutan molar adalah mol/l. Kita boleh menunjukkan istilah ini sebagai "m". Kita boleh mengira kelarutan molar menggunakan KSP, tetapi kita perlu tahu ion -ion yang dihasilkan oleh pemisahan semasa pembubaran bahan dalam penyelesaian.

Marilah kita mempertimbangkan contoh; Sekiranya ab dibubarkan dalam larutan akueus, ia memisahkan produk a dan b ionik. Persamaan untuk pembubaran ini adalah seperti berikut:
Ab(s) ⇌ a(aq) + B(aq)
Menurut stoikiometri tindak balas ini, jika kepekatan akhir A adalah "x", maka kepekatan akhir B juga "x". Kemudian, persamaan produk kelarutan untuk tindak balas ini adalah;
Ksp = [a] [b]
= [x] [x]
= x2
Di sini, x adalah kelarutan molar. Oleh itu, jika kita tahu KSP tindak balas, kita boleh mengira x, kelarutan molar reaksi.
Apakah kelarutan produk yang berterusan?
Kelarutan produk pemalar atau kelarutan produk pemalar adalah pemalar keseimbangan untuk pembubaran bahan pepejal dalam larutan berair. Oleh itu, ia menggambarkan pembubaran bahan pepejal dalam larutan berair, dan ia mewakili tahap di mana larut larut dalam larutan. Kita boleh menunjukkannya sebagai ksp. Umumnya, KSP dikira dengan mengalikan kepekatan produk ionik selepas pembubaran bahan tersebut. Untuk pembubaran ab2, Reaksi adalah seperti berikut:
Ab2 (s) ⇌ a(aq) + 2b(aq)
Untuk tindak balas di atas, pemalar kelarutan produk atau KSP adalah seperti berikut:
KSP = [a(aq)] [B(aq)]2
Apakah perbezaan antara kelarutan molar dan pemalar kelarutan produk?
Kedua -duanya, kelarutan molar dan kelarutan kelarutan produk, menerangkan pembubaran bahan dalam penyelesaian. Walau bagaimanapun, perbezaan utama antara kelarutan molar dan pemalar kelarutan produk adalah bahawa kelarutan molar menggambarkan pembubaran bahan seliter penyelesaian, sedangkan pemalar kelarutan produk menerangkan pembubaran bahan pepejal dalam larutan akueus.
Selain itu, kelarutan molar adalah bilangan tahi lalat bahan yang membubarkan seliter penyelesaian sebelum tepu. Sementara itu, pemalar kelarutan produk adalah, atau pemalar produk kelarutan adalah pemalar keseimbangan untuk pembubaran bahan pepejal dalam larutan berair. Kita boleh menunjukkan kelarutan molar sebagai "m" dan kelarutan produk tetap sebagai "KSP".
Di bawah Infographic meringkaskan perbezaan antara kelarutan molar dan kelarutan produk yang berterusan.
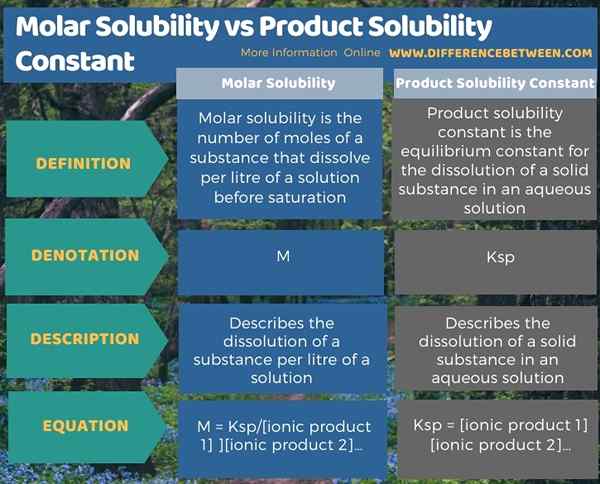
Ringkasan -Kelarutan Molar vs Pemarahan Kelarutan Produk
Ringkasnya, kedua -duanya, kelarutan molar dan pemalar kelarutan produk, menerangkan pembubaran bahan dalam penyelesaian. Walau bagaimanapun, perbezaan utama antara kelarutan molar dan pemalar kelarutan produk adalah bahawa kelarutan molar menggambarkan pembubaran bahan seliter penyelesaian, sedangkan pemalar kelarutan produk menerangkan pembubaran bahan pepejal dalam larutan akueus.
Rujukan:
1. "Pemalar Produk Kelarutan, KSP."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
2. "Kelarutan Molar."Wikipedia, Yayasan Wikimedia, 5 Apr. 2019, boleh didapati di sini.
3. "Keseimbangan Kelarutan."Wikipedia, Yayasan Wikimedia, 26 Sept. 2019, boleh didapati di sini.


