Perbezaan antara siri Lyman dan Balmer
The Perbezaan utama Antara siri Lyman dan Balmer ialah Lyman Series membentuk apabila elektron teruja mencapai tahap tenaga n = 1 manakala siri Balmer membentuk apabila elektron teruja mencapai tahap tenaga n = 2.
Siri Lyman dan Siri Balmer dinamakan sempena saintis yang menemui mereka. Ahli fizik Theodore Lyman menemui siri Lyman sementara Johann Balmer menemui siri Balmer. Ini adalah jenis garis spektrum hidrogen. Siri dua baris ini timbul daripada spektrum pelepasan atom hidrogen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu siri Lyman
3. Apa itu siri Balmer
4. Perbandingan sampingan - siri Lyman vs Balmer dalam bentuk jadual
5. Ringkasan
Apa itu siri Lyman?
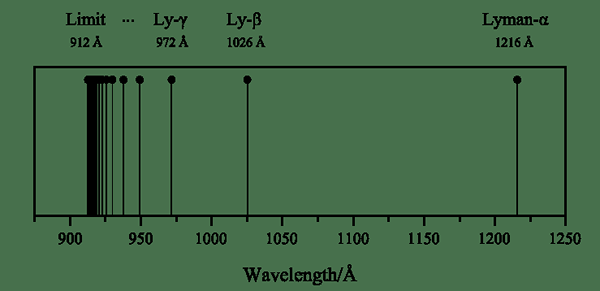
Siri Lyman adalah siri garis spektrum hidrogen yang terbentuk apabila elektron teruja datang ke tahap tenaga n = 1. Dan, tahap tenaga ini adalah tahap tenaga terendah atom hidrogen. Pembentukan siri baris ini adalah disebabkan oleh garis pelepasan ultraviolet atom hidrogen.

Rajah 01: Siri Lyman
Selain itu, kita boleh menamakan setiap peralihan menggunakan huruf Yunani; Peralihan elektron teruja dari n = 2 hingga n = 1 adalah garis spektrum Lyman alpha, dari n = 3 hingga n = 1 adalah beta Lyman, dan sebagainya. Ahli fizik Theodore Lyman menemui siri Lyman pada tahun 1906.
Apa itu siri Balmer?
Siri Balmer adalah siri garis spektrum hidrogen yang terbentuk apabila elektron teruja datang ke tahap tenaga n = 2. Selanjutnya, siri ini menunjukkan garis spektrum untuk pelepasan atom hidrogen, dan ia mempunyai beberapa garis balmer ultraviolet yang menonjol yang mempunyai panjang gelombang yang lebih pendek daripada 400 nm.

Rajah 02: Siri Balmer
Siri Balmer dikira menggunakan formula Balmer, yang merupakan persamaan empirikal yang ditemui oleh Johann Balmer pada tahun 1885.
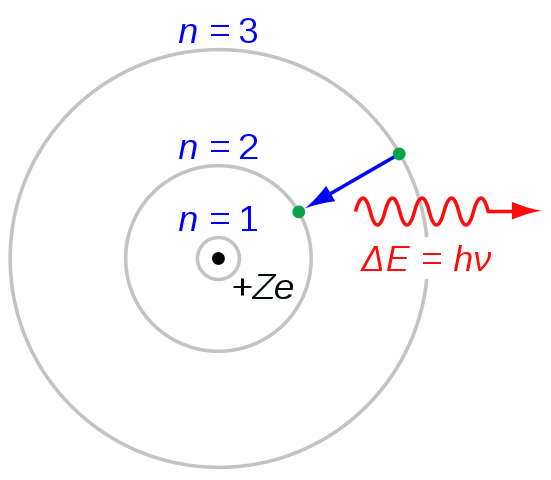
Rajah 03: Peralihan elektron untuk pembentukan siri Balmer
Semasa menamakan setiap baris dalam siri ini, kami menggunakan huruf "H" dengan huruf Yunani. Sebagai contoh, dari n = 3 hingga n = 2 peralihan menimbulkan garis H-alpha, dari n = 4 hingga n = 2 menimbulkan garis h-beta dan sebagainya. Surat "H" bermaksud "Hidrogen". Apabila mempertimbangkan panjang gelombang, garis spektrum pertama berada dalam julat spektrum elektromagnetik yang kelihatan. Dan, baris pertama ini mempunyai warna merah terang.
Apakah perbezaan antara siri Lyman dan Balmer?
Siri Lyman dan Balmer adalah siri garis spektrum hidrogen yang timbul daripada spektrum pelepasan hidrogen. Perbezaan utama antara siri Lyman dan Balmer ialah siri Lyman membentuk apabila elektron teruja mencapai tahap tenaga n = 1 manakala siri Balmer membentuk apabila elektron teruja mencapai tahap tenaga n = 2. Beberapa baris siri Blamer berada dalam julat spektrum elektromagnetik yang kelihatan. Tetapi, siri Lyman berada dalam julat panjang gelombang UV.
Siri Lyman dan Siri Balmer dinamakan sempena saintis yang menemui mereka. Ahli fizik Theodore Lyman menemui siri Lyman sementara Johann Balmer menemui siri Balmer. Semasa menamakan garis spektrum, kami menggunakan huruf Yunani. Untuk garis dalam siri Lyman, nama-nama itu adalah seperti Lyman Alpha, Lyman Beta dan sebagainya sedangkan untuk garis-garis dalam siri Balmer nama-nama adalah sebagai H-alpha, H-beta, dll.
Di bawah Infographic meringkaskan perbezaan antara siri Lyman dan Balmer.

Ringkasan -Siri Lyman vs Balmer
Siri Lyman dan Balmer adalah siri garis spektrum hidrogen yang timbul daripada spektrum pelepasan hidrogen. Perbezaan utama antara siri Lyman dan Balmer ialah siri Lyman membentuk apabila elektron teruja mencapai tahap tenaga n = 1, sedangkan siri Balmer membentuk apabila elektron teruja mencapai tahap tenaga n = 2. Ahli fizik Theodore Lyman menemui siri Lyman sementara Johann Balmer menemui siri Balmer.
Rujukan:
1. "Siri Balmer."Wikipedia, Yayasan Wikimedia, 21 Okt. 2019, boleh didapati di sini.
2. "Siri Lyman."Wikipedia, Yayasan Wikimedia, 7 Okt. 2019, boleh didapati di sini.
Ihsan gambar:
1. "Lymanseries" oleh Lymanseries1.gif: pemuat naik asal adalah adriferr di en.Kerja Wikipediaderivatif: OrangeDog (Ceramah • Sumbangan) - Lymanseries1.gifvectorised dari asal. Ketepatan juga dikurangkan untuk bersetuju dengan kebanyakan sumber., (CC BY-SA 3.0) melalui Commons Wikimedia
2. "Spektrum Hidrogen yang Terlihat" oleh Jan Homann - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
3. "Model Atom Bohr" oleh Jabberwok (CC BY-SA 3.0) melalui Commons Wikimedia


