Perbezaan antara sebatian ionik dan molekul
The Perbezaan utama antara sebatian ionik dan molekul ialah Sebatian ionik mempunyai daya tarikan elektrostatik antara kation dan anion manakala sebatian molekul hanya mempunyai ikatan kimia kovalen antara atom.
Unsur -unsur kimia dapat bergabung antara satu sama lain untuk membentuk sebatian kimia. Unsur -unsur mengikat bersama melalui ikatan kimia yang mempunyai ciri -ciri ionik atau kovalen. Sekiranya sebatian mempunyai ikatan ionik, kami memanggilnya sebagai sebatian ionik, dan jika mereka mempunyai ikatan kovalen, maka mereka adalah sebatian molekul. Oleh itu, perbezaan utama antara sebatian ionik dan molekul terletak pada ikatan kimia antara atom.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Whare adalah sebatian ionik
3. Apakah sebatian molekul
4. Perbandingan sampingan - sebatian molekul ionik dalam bentuk jadual
5. Ringkasan
Apakah sebatian ionik?
Sebatian ionik adalah sebatian kimia yang mempunyai kation dan anion yang mengikat antara satu sama lain melalui ikatan ionik. Oleh itu, terdapat daya tarikan elektrostatik antara kation dan anion. Walau bagaimanapun, sebatian mempunyai caj neutral secara keseluruhan kerana jumlah caj kation dinetralkan oleh jumlah caj anion. Ion ini boleh sama ada monoatomik atau polyatomik.
Biasanya, sebatian ionik yang mengandungi ion hidrogen (h+) kerana kation adalah "asid". Sebaliknya, ion asas seperti ion hidroksida (OH-) hadir di pangkalan. Sekiranya tidak ada ion hidrogen atau ion hidroksida dalam sebatian ionik, maka kita namakannya sebagai "garam".

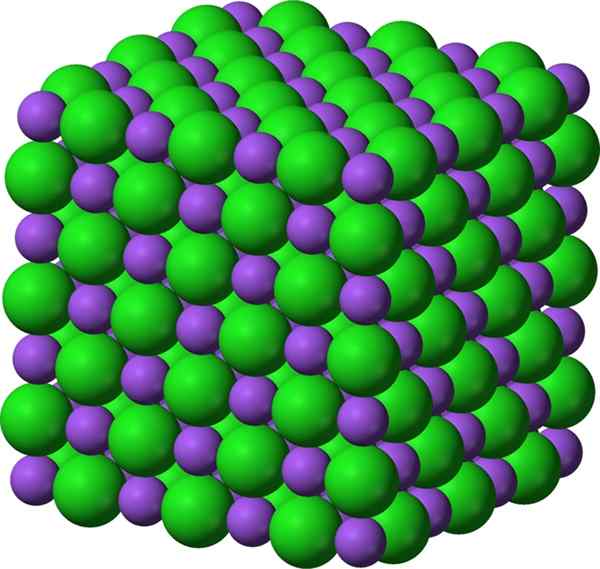
Rajah 01: Sebatian ionik natrium klorida, yang merupakan garam
Beberapa sebatian ionik seperti bentuk garam dari tindak balas peneutralan asid-asas. Sesetengah kompaun membentuk melalui penyejatan pelarut, tindak balas hujan, tindak balas pepejal, pembekuan, tindak balas pemindahan elektron antara logam dan bukan logam, dll. Biasanya, sebatian ini mempunyai titik lebur dan mendidih yang tinggi. Kebanyakan masa mereka sukar dan rapuh. Dalam keadaan pepejal mereka, hampir semua sebatian ionik adalah penebat elektrik, dan mereka boleh menjadi sangat konduktif apabila dibubarkan dalam pelarut seperti air kerana kemudian kation dan anion dapat bergerak dengan bebas.
Apakah sebatian molekul?
Sebatian molekul adalah sebatian kimia yang mengandungi atom yang terikat antara satu sama lain melalui ikatan kimia kovalen. Oleh itu, sebatian ini membentuk apabila atom berkongsi elektron yang tidak berpasangan antara satu sama lain. Atom yang terlibat dalam perkongsian elektron ini mempunyai nilai elektronegativiti yang serupa.
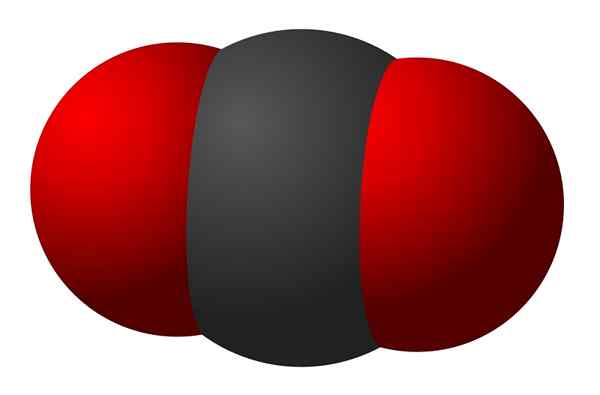
Rajah 02: Gambar rajah molekul triatom yang mempunyai ikatan kovalen antara tiga atom
Biasanya, sebatian molekul mempunyai titik lebur dan mendidih yang agak rendah kerana atom tidak saling melekat pada satu sama lain. Begitu juga, sebatian ini lembut dan agak fleksibel. Berbanding dengan sebatian ionik, sebatian molekul ini sangat mudah terbakar. Ini kerana hampir semua bahan mudah terbakar adalah sebatian molekul yang terdiri daripada atom karbon dan hidrogen. Tidak seperti sebatian ionik, mereka tidak dapat menjalankan elektrik apabila dibubarkan dalam pelarut kerana tidak ada ion yang tersedia untuk dipisahkan setelah dibubarkan.
Apakah perbezaan antara sebatian ionik dan molekul?
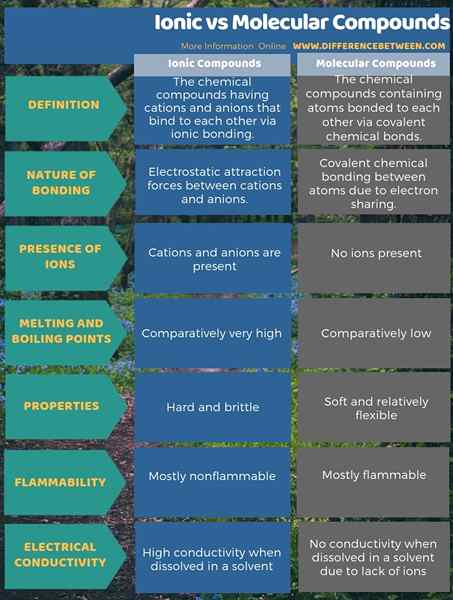
Sebatian ionik adalah sebatian kimia yang mempunyai kation dan anion yang mengikat antara satu sama lain melalui ikatan ionik manakala sebatian molekul adalah sebatian kimia yang mengandungi atom yang terikat antara satu sama lain melalui ikatan kimia kovalen. Oleh itu, perbezaan antara sebatian ionik dan molekul terletak pada sifat ikatan kimia. Itu dia; Perbezaan utama antara sebatian ionik dan molekul adalah bahawa sebatian ionik mempunyai daya tarikan elektrostatik antara kation dan anion manakala sebatian molekul hanya mempunyai ikatan kimia kovalen antara atom.
Sebagai satu lagi perbezaan penting antara sebatian ionik dan molekul, sebatian ionik keras dan rapuh manakala sebatian molekul lembut dan agak fleksibel. Ini terutamanya kerana atom -atom sebatian ionik dipegang bersama dengan ikatan ionik sedangkan dalam atom sebatian molekul melekat antara satu sama lain. Selain itu, titik lebur dan mendidih sebatian ionik sangat tinggi berbanding dengan sebatian molekul.
Ringkasan -Sebatian molekul ionik vs
Sebatian ionik mempunyai ikatan ionik manakala sebatian molekul mempunyai ikatan kovalen. Oleh itu, perbezaan utama antara sebatian ionik dan molekul adalah bahawa sebatian ionik mempunyai daya tarikan elektrostatik antara kation dan anion manakala sebatian molekul hanya mempunyai ikatan kimia kovalen antara atom.
Rujukan:
1. Helmenstine, Anne Marie, PH.D. "Ciri -ciri kompaun kovalen atau molekul."Pemikiran, Jun. 7, 2018. Terdapat di sini
2. "Kompaun Ionik."Wikipedia, Yayasan Wikimedia, 20 Okt. 2018. Terdapat di sini
Ihsan gambar:
1."Natrium-chloride-3D-ionik" oleh Benjah-Bmm27-Kerja sendiri, (domain awam) melalui Commons Wikimedia
2."Karbon-dioksida-3D-VDW" oleh Jacek FH-Kerja Sendiri (CC BY-SA 3.0) melalui Commons Wikimedia


