Perbezaan antara ikatan hidrogen intermolecular dan intramolekul
Perbezaan utama - intermolecular vs ikatan hidrogen intramolekul
Ikatan hidrogen adalah bentuk daya tarikan antara molekul kutub tertentu. Ia adalah jenis ikatan yang lemah daripada ikatan ionik atau kovalen, tetapi daya tarikan yang kuat apabila dibandingkan dengan pasukan dipole-dipole dan pasukan van der waal. Ikatan hidrogen dibentuk jika molekul kutub mempunyai atom elektronegatif yang kuat yang mempunyai pasangan elektron tunggal (yang boleh bertindak sebagai penderma elektron) yang terikat kepada atom hidrogen (penerima elektron). Oleh kerana atom elektronegatif yang kuat dapat menarik elektron ikatan ke arah dirinya daripada atom hidrogen, atom hidrogen mendapat caj positif separa, mengakibatkan pemisahan caj yang kuat. Oleh itu, ikatan hidrogen biasa yang membentuk ikatan kimia adalah ikatan O-H, ikatan N-H, dan ikatan F-H. Terdapat dua bentuk ikatan hidrogen yang boleh dibentuk; ikatan hidrogen intermolecular yang berlaku antara molekul kutub dan ikatan hidrogen intramolekul yang berlaku dalam molekul tunggal yang sama. The Perbezaan utama antara ikatan hidrogen intermolecular dan intramolekul adalah bahawa ikatan hidrogen intermolecular berlaku di antara dua molekul manakala ikatan hidrogen intramolekul berlaku dalam satu molekul tunggal.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah ikatan hidrogen intermolecular
3. Apakah ikatan hidrogen intramolekul
4. Perbandingan sampingan - intermolecular vs ikatan hidrogen intramolekul dalam bentuk tabular
5. Ringkasan
Apakah ikatan hidrogen intermolecular?
Ikatan hidrogen intermolecular berlaku antara molekul berasingan dalam bahan. Oleh itu, penderma elektron dan penerima elektron harus hadir dalam dua molekul berasingan. Sekiranya penderma dan penerima elektron yang betul hadir, sebarang molekul boleh membentuk ikatan hidrogen.

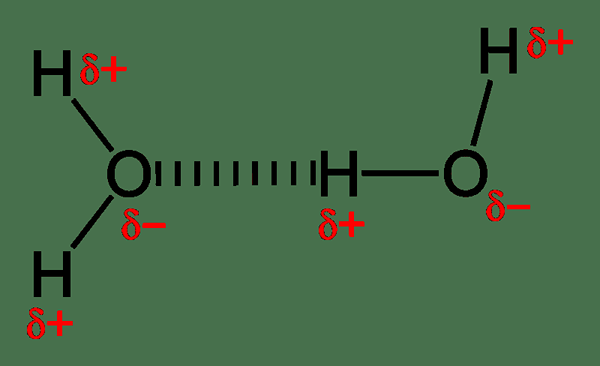
Rajah 01: Ikatan hidrogen intermolecular dalam molekul air
Contoh umum untuk molekul yang boleh membentuk ikatan hidrogen intermolecular adalah molekul air (h2O).Ikatan hidrogen di antara molekul air menyebabkan pembentukan struktur tegar apabila air cair ditukar menjadi ais pepejal.
Apakah ikatan hidrogen intramolekul?
Ikatan hidrogen intramolekul adalah yang berlaku dalam satu molekul.Jenis ikatan hidrogen ini timbul apabila dua kumpulan berfungsi yang mampu membentuk ikatan hidrogen antara satu sama lain hadir dalam molekul tunggal yang sama. Ini bermakna penderma elektron dan penerima elektron harus hadir dalam molekul yang sama.
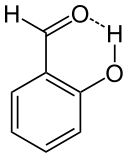
Rajah 02: Ikatan hidrogen intramolekul dalam salisilaldehida
Selain itu, kedua -dua kumpulan berfungsi ini harus diposisikan cukup dekat untuk ikatan hidrogen ini. Contoh molekul yang paling biasa yang menunjukkan ikatan hidrogen jenis ini adalah salisilaldehid (c7H6O2).
Apakah perbezaan antara ikatan hidrogen intermolecular dan intramolekul?
Ikatan hidrogen intermolecular vs intermolecular vs | |
| Ikatan hidrogen intermolecular berlaku antara molekul berasingan dalam bahan. | Ikatan hidrogen intramolekul adalah yang berlaku dalam satu molekul tunggal. |
| Komponen | |
| Ikatan hidrogen intermolecular terbentuk antara dua molekul. | Ikatan hidrogen intramolekul terbentuk antara molekul berasingan. |
Ringkasan -Intermolecular vs ikatan hidrogen intramolekul
Ikatan hidrogen adalah bentuk interaksi dipole-dipole. Tetapi ia adalah jenis bon yang lemah. Terdapat dua bentuk ikatan hidrogen sebagai ikatan hidrogen intermolecular dan intramolekul. Perbezaan antara ikatan hidrogen intermolecular dan intramolekul ialah ikatan hidrogen intermolecular berlaku di antara dua molekul manakala ikatan hidrogen intramolekul berlaku dalam molekul tunggal.
Rujukan:
1."Ikatan hidrogen."Kimia Libretexts, Libretexts, 21 Julai 2016. Terdapat di sini
2."Hidrogen ikatan."Wikipedia, Yayasan Wikimedia, 14 Mar. 2018. Terdapat di sini
Ihsan gambar:
1.'Hydrogen-Bonding-in-Water-2D' (Domain Awam) melalui Commons Wikimedia
2.'Salicylaldehyd Wasserstoffbrücke'by Neurotiker ⇌ - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia


