Perbezaan antara hidrolisis dan dehidrasi

Hydrolysis vs dehidrasi
Air sangat penting untuk kelangsungan hidup makhluk hidup. Ia mempunyai banyak penggunaan. Apabila air tidak dalam kuantiti yang mencukupi, ia memberi kesan kepada banyak reaksi penting dalam badan.
Hydrolysis
Ini adalah tindak balas di mana ikatan kimia dipecahkan menggunakan molekul air. Semasa tindak balas ini, molekul air berpecah menjadi proton dan ion hidroksida. Kemudian kedua -dua ion ini ditambah kepada dua bahagian molekul di mana ikatan dipecahkan. Contohnya, berikut adalah ester. Ikatan ester antara -co dan -o.
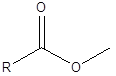
Dalam hidrolisis, proton dari air menambah ke sisi -O, dan ion hidroksida menambah ke sisi -co. Oleh itu, sebagai hasil daripada hidrolisis, alkohol dan asid karboksilik akan membentuk reaktan ketika membentuk ester.
Hidrolisis penting untuk memecahkan polimer yang dibuat oleh pempolimeran pemeluwapan. Polimerisasi pemeluwapan adalah sejenis tindak balas kimia di mana molekul kecil berkumpul untuk membentuk molekul tunggal yang besar. Tindak balas berlaku dalam dua kumpulan berfungsi dalam molekul. Ciri ciri lain dari tindak balas pemeluwapan ialah, semasa tindak balas, molekul kecil seperti air hilang. Oleh itu, hidrolisis adalah proses pempolimeran pemeluwapan yang boleh diterbalikkan. Contoh di atas menunjukkan hidrolisis molekul organik.
Sebilangan besar tindak balas hidrolisis molekul organik perlu dipangkin dengan asid dan pangkalan yang kuat. Walau bagaimanapun, semata -mata, apabila garam asid lemah atau asas lemah dibubarkan di dalam air, ia juga mengalami hidrolisis. Air mengionkan dan juga garam memisahkan kation dan anion. Sebagai contoh, apabila natrium asetat dibubarkan dalam air, asetat bertindak balas dengan proton dan membentuk asid asetik manakala natrium berinteraksi dengan ion hidroksil.
Dalam sistem hidup, tindak balas hidrolisis sangat biasa. Dalam sistem pencernaan, ini berlaku untuk mencerna makanan yang kita pengambilan. Menjana tenaga dari ATP juga disebabkan oleh tindak balas hidrolisis hubungan pyrophosphate. Sebilangan besar tindak balas hidrolisis biologi ini dikatalisis dengan enzim.
Dehidrasi
Dehidrasi adalah keadaan di mana tidak ada tahap normal air yang diperlukan. Apabila dirujuk kepada sistem biologi, ini disebabkan oleh kehilangan cecair badan yang teruk (contohnya, darah). Terdapat tiga jenis dehidrasi sebagai hipotonik, hipertonik dan isotonik. Oleh kerana tahap elektrolit secara langsung mempengaruhi paras air, adalah penting untuk mengekalkan keseimbangan elektrolit dalam badan untuk mengekalkan keseimbangan osmotik.
Dehidrasi boleh disebabkan dalam beberapa cara. Lulus air kencing yang berlebihan, cirit -birit, kehilangan darah akibat kemalangan, dan berpeluh berlebihan adalah beberapa cara biasa. Dehidrasi boleh menyebabkan sakit kepala, menurunkan tekanan darah, pening, pengsan. Dalam keadaan dehidrasi yang melampau, ia menyebabkan ketidaksadaran, dan kematian.
Dehidrasi dapat dicegah dengan minum air yang mencukupi. Apabila banyak air hilang dari badan, ia harus dibekalkan semula (rehidrasi oral, suntikan dll).
| Apakah perbezaan antara hidrolisis dan dehidrasi? • Dehidrasi adalah keadaan mempunyai sedikit air daripada tahap normal. • Hidrolisis adalah tindak balas di mana ikatan kimia dipecahkan menggunakan molekul air. • Dehidrasi mempengaruhi tindak balas hidrolisis kerana untuk tindak balas hidrolisis berlaku harus ada air. |


